S
最終更新日:2024.12.10
We are not selling antibodies. / Nous ne vendons pas d'anticorps. / Wir verkaufen keinen Antikorper.
No vendemos un anticuerpo. / 我們沒銷售抗體 / мы не продавать антило.
抗体は販売していません。
| Anti- | 抗体名 | 略称 | 別名 | HOST | CLONE名 | 適用 |
|---|---|---|---|---|---|---|
| Human | S-100 protein (β鎖) | S100 | Rabbit | EP32 | P | |
| Rabbit* | Sarcomeric muscle actin | Sr-1 | →α-Sr-1 | Mouse | Sr-1 | P |
| Human | SCC antigen | SCC | Mouse | 10C12 | P | |
| Human | SCF receptor (SCFR) | cKit | →CD117,→c-kit | Rabbit | Poly | P |
| reticulum Ca++ ATPase type1 |
Sarcoplasmic reticulum Ca-transporting ATPase, fast twitch skeletal muscle |
|||||
| reticulum Ca++ ATPase type2 |
Sarcoplasmic reticulum Ca-transporting ATPase, slow twitch skeletal muscle |
|||||
| Human | Serotonin | Sero | →5-Hydroxytryptamin(5-HT) | Rabbit | Poly | P |
| Human | Smooth Muscle Actin,α | SMA | →α-SMA | Mouse | 1A4 | P |
| Human | Somatostatin | Somat | SRIF,GIH,GIF | Rabbit | Poly | P |
| Human | Squamous cell carcinoma (related) antigen2 (SCC) |
SCC | SCC2, SCCA2, SerpinB4 | Mouse | 10C12 | P |
| Rabbit* | Sr-1 | Sr-1 | →α-Sr-1 | Mouse | Sr-1 | P |
| Human | Stem Cell Factor receptor | cKit | →CD117,→c-kit | Rabbit | Poly | P |
| Human | Substance-P | SubP | Neurokinin | Rabbit | Poly | P |
| Human | Surfactant apoprotein-A | SP-A | Surfactant protein-A | Mouse | 6F10 | P |
| Human,Mo | Survivin | SVV | BIRC5,IAP4,AIP4 | Rabbit | Poly | P* |
| Human,Mo | Survivin | SVV | BIRC5,IAP4,AIP4 | Mouse | EP119 | P* |
| Human | Synaptophysin | Synap | p38,SVP38 | Mouse | 27G12 | P* |
| Human | Syndecan-1 | SYND1 | →CD138 | Mouse | B-A38 | P* |
| S100 protein (S-100) | |
|---|---|
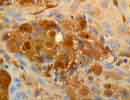 S100p Melanoma X400 |
S100蛋白はTroponinCなどと同様にEF-handと呼ばれる構造を有するカルシウム結合性の8〜14kDほどの低分子酸性蛋白で、キナーゼ活性の抑制やp53やTau蛋白などの燐酸化を阻害する。グリア細胞、シュワン細胞、メラニン細胞、軟骨細胞など主に神経外胚葉由来の広範な細胞の細胞質及び核に含まれ、陽性となる腫瘍もかなり多く、Schwannoma,Chordoma,Melanomaなどや軟部では軟骨系、脂肪系腫瘍などにも陽性。最初ウシの脳から発見されたものだが、種特異性が低く他の動物にも使用できるうえ、ホルマリン固定に対して安定した抗原性を示し免疫組織化学では良く利用される。反面、「S100」という名称が"Sulfateに100%溶解する"という意味から付いたと言われるように非常に溶解性が高く凍結切片では抗原が溶出することがある。 |
S100AとS100B
S100蛋白はα(Gene:1q21)、β(Gene:21q22)の2つのサブユニットからなる二量体構造をとり、α鎖-α鎖およびα鎖-β鎖から成るS100Aとβ鎖-β鎖から成るS100Bとがありisoformも多い。(現在ではS100A1〜A10などに再分類されている。)また、S100蛋白にはEF-handモチーフが2つあり、N末端寄りの方はfamily間で共通し、C末端側の方が各メンバーごとに異なっている。
α鎖・β鎖ともアミノ酸約90個、分子量約10000でアミノ酸配列にはおよそ60%の相同性があるが、S100Bは主に神経組織に多く他に軟骨、脂肪組織に多く含まれるのに対してS100Aは骨格筋、腎に多いと言われている。(詳細な分布は「病理と臨床」Vol.8(1990),臨時増刊号,p146に詳しく載っている)
なお、2024年1月より使用抗体をPolyclonal抗体からMonoclonal抗体に変更したが、この抗体(Clone: EP32)はヒトS100蛋白 β鎖の合成ペチドを免疫源としている。 |
alpha GSELETAMET LINVFHAHSG KEGDKYKLSK KELKELLQTE LSGFLDAQKD VDAVDKVMKE LDENGDGEVD FQEYVVLVAA LTVACNNFFW ENS beta SELEKAMVAL IDVFHQYSGR EGDKHKLKKS ELKELINNEL SHFLEEIKEQ EVVDKVMETL DNDGDGECDF QEFMAFVAMV TTACHEFFEH E |
| α-SG | β-SG | γ-SG | δ-SG |
|---|---|---|---|
 筋生検 凍結 X400 Gene:17q21,364aa 欠損 → LGMD type 2D |
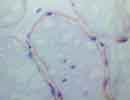 筋生検 凍結 X400 Gene:4q12,318aa 欠損 → LGMD type 2E |
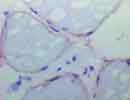 筋生検 凍結 X400 Gene:13q12,290aa 欠損 → LGMD type 2C |
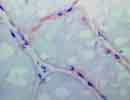 筋生検 凍結 X400 Gene:5q33,290aa 欠損 → LGMD type 2F |
| Sarcoglycan(SG)はDystroglycanに結合し骨格筋細胞の細胞膜に存在する糖蛋白で、肢帯(Limb-Girdle)型筋ジストロフィー(LGMD)ではその欠損がみられる。
α-SG(50kD dystrophin associated glycoprotein:50DAG,別名:Adhalin)、β-SG(43DAG)、γ-SG(35DAG)、δ-SG(35DAG)があり、それぞれ遺伝子の位置とその異常によるLGMDの型を図の下に示す。(他に ε や ζ もある)
なお、上図ではα-SGのみ陰性である。(使用抗体 α-SG=Adi20/A6,β-SG=Bsarc/5B1,δ-SG=DSarc3/12C1,γ-SG=35DAG.21B5) (リストより削除しました。) → 【 D 】 Dystrophin の項参照 |
|||
alpha
MAETLFWTPL LVVLLAGLGD TEAQQTTLHP LVGRVFVHTL DHETFLSLPE HVAVPPAVHI TYHAHLQGHP DLPRWLRYTQ RSPHHPGFLY GSATPEDRGL
QVIEVTAYNR DSFDTTRQRL VLEIGDPEGP LLPYQAEFLV RSHDAEEVLP STPASRFLSA LGGLWEPGEL QLLNVTSALD RGGRVPLPIE GRKEGVYIKV
GSASPFSTCL KMVASPDSHA RCAQGQPPLL SCYDTLAPHF RVDWCNVTLV DKSVPEPADE VPTPGDGILE HDPFFCPPTE APDRDFLVDA LVTLLVPLLV
ALLLTLLLAY VMCCRREGRL KRDLATSDIQ MVHHCTIHGN TEELRQMAAS REVPRPLSTL PMFNVHTGER LPPRVDSAQV PLILDQH (24-387)
beta
MAAAAAAAAE QQSSNGPVKK SMREKAVERR SVNKEHNSNF KAGYIPIDED RLHKTGLRGR KGNLAICVII LLFILAVINL IITLVIWAVI RIGPNGCDSM
EFHESGLLRF KQVSDMGVIH PLYKSTVGGR RNENLVITGN NQPIVFQQGT TKLSVENNKT SITSDIGMQF FDPRTQNILF STDYETHEFH LPSGVKSLNV
QKASTERITS NATSDLNIKV DGRAIVRGNE GVFIMGKTIE FHMGGNMELK AENSIILNGS VMVSTTRLPS SSSGDQLGSG DWVRYKLCMC ADGTLFKVQV
TSQNMGCQIS DNPCGNTH
gamma
VREQYTTATE GICIERPENQ YVYKIGIYGW RKRCLYLFVL LLLIILVVNL ALTIWILKVM WFSPAGMGHL CVTKDGLRLE GESEFLFPLY AKEIHSRVDS
SLLLQSTQNV TVNARNSEGE VTGRLKVGPK MVEVQNQQFQ INSNDGKPLF TVDEKEVVVG TDKLRVTGPE GALFEHSVET PLVRADPFQD LRLESPTRSL
SMDAPRGVHI QAHAGKIEAL SQMDILFHSS DGMLVLDAET VCLPKLVQGT WGPSGSSQSL YEICVCPDGK LYLSVAGVST TCQEHSHICL
delta
MMPQEQYTHH RSTMPGSVGP QVYKVGIYGW RKRCLYFFVL LLMILILVNL AMTIWILKVM NFTIDGMGNL RITEKGLKLE GDSEFLQPLY AKEIQSQPGN
ALYFKSARNV TVNILNDQTK VLTQLITGPK AVEAYGKKFE VKTVSGKLLF SADNNEVVVG AERLRVLGAE GTVFPKSIET PNVRADPFKE LRLESPTRSL
VMEAPKGVEI NAEAGNMEAT CRTELRLESK DGEIKLDAAK IRLPRLPHGS YTPTGTRQKV FEICVCANGR LFLSQAGAGS TCQINTSVCL
(Mus:Alpha 83%.Beta 91%,Gamma 77%,Delta 88%)
|
■ SERCA ■ | |
Endoplasmic reticulum class 1/2 Ca ATPase) Endoplasmic reticulum class 1/2 Ca ATPase) | |
|---|---|
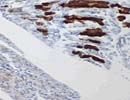
 SERCA1 骨格筋 X50 ホルマリン固定(type II fiber)  SERCA2 骨格筋 X50 ホルマリン固定 (type I fiber) |
名前の通り筋小胞体および滑面小胞体膜に存在するATP分解酵素(EC:3.6.3.8)で、名称が非常に長いので通常は略して”SERCA”(セルカ)と呼ばれる。ATP分解時のエネルギーを利用してイオンを能動輸送するcation transport ATPases familyのひとつ(subfamily IIA)で、P-type ATPaseに属し、Caイオンを小胞体内に再吸収するカルシウムポンプである。
SERCAには1〜3があり、骨格筋ではSERCA1(Gene:16p12.1;ATP2A1,1001aa)はTroponin Tと同様にFast muscle fiber (type II fiber)に、SERCA2(Gene:12q23-q24.1;ATP2A2/ATP2B ,1042aa)は2つのisoformのうちSERCA2aがSlow muscle fiber (type I fiber)に主に含まれる。 SERCA1(type II )とSERCA2(type I )は互いに逆転した反応を示す。凍結切片のみでなくホルマリン固定パラフィン切片でも反応し、筋生検に際して凍結切片で行われるATPase染色のpH9.4(type II )とpH4.3処理(type I )にそれぞれ代わり得る。(うまく固定できた組織ではtype IIa、IIbの染分けも可能)なお、SERCA1の異常として Brody病、SERCA2の異常として Darier病が知られている。 またSERCAはヒトとげっ歯類のホモログとで90%以上の相同性があるほか、特にSERCA2は種を越え広く保存されており、この抗体でもイヌ(Canis)、ニワトリ(Gallus)等での交差反応を確認している。 (ついにSERCA1、SERCA2ともに削除することになりました。いずれも残念な抗体です。) |
SERCA の artifactによる反応の変化 | ||
 |
 |
SERCAはホルマリン固定標本でも反応する点で役立つが万能ではない。図左:画面右上に強い反応がみられるが、左下にも弱い反応がみられる。同じ試料でありながら部位によりこれだけの反応差がみられることがある。図右:SERCAの反応はよく見ると微細顆粒状であるが、時に図のように反応部位が線維の片側に偏り、あたかも魚燐状に見えることがある。いずれも固定ムラの影響が原因と考えられる。 |
SERCA1
MEAAHAKTTE ECLAYFGVSE TTGLTPDQVK RNLEKYGLNE LPAEEGKTLW ELVIEQFEDL LVRILLLAAC ISFVLAWFEE GEETITAFVE PFVILLILIA
NAIVGVWQER NAENAIEALK EYEPEMGKVY RADRKSVQRI KARDIVPGDI VEVAVGDKVP ADIRILAIKS TTLRVDQSIL TGESVSVIKH TEPVPDPRAV
NQDKKNMLFS GTNIAAGKAL GIVATTGVGT EIGKIRDQMA ATEQDKTPLQ QKLDEFGEQL SKVISLICVA VWLINIGHFN DPVHGGSWFR GAIYYFKIAV
ALAVAAIPEG LPAVITTCLA LGTRRMAKKN AIVRSLPSVE TLGCTSVICS DKTGTLTTNQ MSVCKMFIID KVDGDICLLN EFSITGSTYA PEGEVLKNDK
PVRPGQYDGL VELATICALC NDSSLDFNEA KGVYEKVGEA TETALTTLVE KMNVFNTDVR SLSKVERANA CNSVIRQLMK KEFTLEFSRD RKSMSVYCSP
AKSSRAAVGN KMFVKGAPEG VIDRCNYVRV GTTRVPLTGP VKEKIMAVIK EWGTGRDTLR CLALATRDTP PKREEMVLDD SARFLEYETD LTFVGVVGML
DPPRKEVTGS IQLCRDAGIR VIMITGDNKG TAIAICRRIG IFGENEEVAD RAYTGREFDD LPLAEQREAC RRACCFARVE PSHKSKIVEY LQSYDEITAM
TGDGVNDAPA LKKAEIGIAM GSGTAVAKTA SEMVLADDNF STIVAAVEEG RAIYNNMKQF IRYLISSNVG EVVCIFLTAA LGLPEALIPV QLLWVNLVTD
GLPATALGFN PPDLDIMDRP PRSPKEPLIS GWLFFRYMAI GGYVGAATVG AAAWWFLYAE DGPHVNYSQL THFMQCTEDN THFEGIDCEV FEAPEPMTMA
LSVLVTIEMC NALNSLSENQ SLLRMPPWVN IWLLGSICLS MSLHFLILYV DPLPMIFKLR ALDLTQWLMV LKISLPVIGL DEILKFVARN YLEDPEDERR
K (Rab:91% Bos:90% Rat:92% Mus:91% Gal:86%)
SERCA2
MENAHTKTVE EVLGHFGVNE STGLSLEQVK KLKERWGSNE LPAEEGKTLL ELVIEQFEDL LVRILLLAAC ISFVLAWFEE GEETITAFVE PFVILLILVA
NAIVGVWQER NAENAIEALK EYEPEMGKVY RQDRKSVQRI KAKDIVPGDI VEIAVGDKVP ADIRLTSIKS TTLRVDQSIL TGESVSVIKH TDPVPDPRAV
NQDKKNMLFS GTNIAAGKAM GVVVATGVNT EIGKIRDEMV ATEQERTPLQ QKLDEFGEQL SKVISLICIA VWIINIGHFN DPVHGGSWIR GAIYYFKIAV
ALAVAAIPEG LPAVITTCLA LGTRRMAKKN AIVRSLPSVE TLGCTSVICS DKTGTLTTNQ MSVCRMFILD RVEGDTCSLN EFTITGSTYA PIGEVHKDDK
PVNCHQYDGL VELATICALC NDSALDYNEA KGVYEKVGEA TETALTCLVE KMNVFDTELK GLSKIERANA CNSVIKQLMK KEFTLEFSRD RKSMSVYCTP
NKPSRTSMSK MFVKGAPEGV IDRCTHIRVG STKVPMTSGV KQKIMSVIRE WGSGSDTLRC LALATHDNPL RREEMHLEDS ANFIKYETNL TFVGCVGMLD
PPRIEVASSV KLCRQAGIRV IMITGDNKGT AVAICRRIGI FGQDEDVTSK AFTGREFDEL NPSAQRDACL NARCFARVEP SHKSKIVEFL QSFDEITAMT
GDGVNDAPAL KKAEIGIAMG SGTAVAKTAS EMVLADDNFS TIVAAVEEGR AIYNNMKQFI RYLISSNVGE VVCIFLTAAL GFPEALIPVQ LLWVNLVTDG
LPATALGFNP PDLDIMNKPP RNPKEPLISG WLFFRYLAIG CYVGAATVGA AAWWFIAADG GPRVSFYQLS HFLQCKEDNP DFEGVDCAIF ESPYPMTMAL
SVLVTIEMCN ALNSLSENQS LLRMPPWENI WLVGSICLSM SLHFLILYVE PLPLIFQITP LNVTQWLMVL KISLPVILMD ETLKFVARNY LEPGKECVQP
ATKSCSFSAC TDGISWPFVL LIMPLVIWVY STDTNFSDMF WS
(Can:97% Fel:96% Rab:97% Sus:97% Equ:97% Rat:97% Mus:96% Gal:92% Frog:90%)
|
■ Selectin (LECAM,CD62) family ■ | |
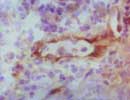 E-selectin 凍結 X 400 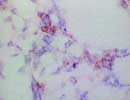 L-selectin 凍結 X 400 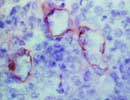 P-selectin 凍結 X 400 |
「セレクチン」とは"Select"(選ぶ)と"Lectin"の合成による造語で、レクチン様構造を有し特定の糖鎖リガンドと選択的に結合することによる。(慌てていると間違いそうだが、勿論「セクレチン Secretin」とは別のもの)
細胞接着分子の一つであり、レクチン様構造の他にEGF様構造、補体結合蛋白様構造を有する特徴から Lectin-Epidermal growth factor-Complement related cell Adhesion Molecle(LECAM あるいはLECCAM:レッキャム)とも呼ばれる。また炎症などに際して活性化された白血球などに発現し、白血球分化抗原としてはCD62に分類されている。 familyにはE,L,Pの3種類があり、それぞれ血管内皮 Endothel、白血球 Leukocyte、血小板 Platletというように主な発現部位を示しており共通のリガンドとしてはCD15sやCA19-9が知られている。 E-Selectin(CD62E,LECAM-2)(約110kDa,Gene:1q23)は、IL-1やTNF-αなどのサイトカイン刺激により主に血管内皮細胞に発現し、白血球の接着とローリングに関与する。 ELAM-1(Endothelial-leukocyte adhesion molecule-1)とも呼ばれる。 L-Selectin(CD62L,LECAM-1)(70〜120kDa前後,Gene:1q23)は主に骨髄細胞を含む各種の白血球に発現しており、炎症時に血管内皮細胞との接着に関与するほか、リンパ球のリンパ節へのホーミングに際しても重要な働きをする。別名はLAM-1(Leukocyte adhesion molecule-1)、MEL14、LEAM-1、TQ1、Leu8など。 P-Selectin(CD62P,LECAM-3)(約140kDa,Gene:1q23)は主に血小板(α顆粒)や血管内皮(Wibel-Palade顆粒)に存在しており、 Thrombin刺激などにより細胞膜上に発現し白血球と接着する。別名はPADGEN(platelet activation dependent granule external membrane)、 GMP-140(Granule membrane protein-140kD)など。 (リストから削除しました) |
E-selectin:
MIASQFLSAL TLVLLIKESG AWSYNTSTEA MTYDEASAYC QQRYTHLVAI QNKEEIEYLN SILSYSPSYY WIGIRKVNNV WVWVGTQKPL TEEAKNWAPG
EPNNRQKDED CVEIYIKREK DVGMWNDERC SKKKLALCYT AACTNTSCSG HGECVETINN YTCKCDPGFS GLKCEQIVNC TALESPEHGS LVCSHPLGNF
SYNSSCSISC DRGYLPSSME TMQCMSSGEW SAPIPACNVV ECDAVTNPAN GFVECFQNPG SFPWNTTCTF DCEEGFELMG AQSLQCTSSG NWDNEKPTCK
AVTCRAVRQP QNGSVRCSHS PAGEFTFKSS CNFTCEEGFM LQGPAQVECT TQGQWTQQIP VCEAFQCTAL SNPERGYMNC LPSASGSFRY GSSCEFSCEQ
GFVLKGSKRL QCGPTGEWDN EKPTCEAVRC DAVHQPPKGL VRCAHSPIGE FTYKSSCAFS CEEGFELHGS TQLECTSQGQ WTEEVPSCQV VKCSSLAVPG
KINMSCSGEP VFGTVCKFAC PEGWTLNGSA ARTCGATGHW SGLLPTCEAP TESNIPLVAG LSAAGLSLLT LAPFLLWLRK CLRKAKKFVP ASSCQSLESD
GSYQKPSYIL (Can:77% Bos:66% Equ:80% Sus:59% Rab:65% Rat:70% Mus:71%)
L-selectin:
MIFPWKCQST QRDLWNIFKL WGWTMLCCDF LAHHGTDCWT YHYSEKPMNW QRARRFCRDN YTDLVAIQNK AEIEYLEKTL PFSRSYYWIG IRKIGGIWTW
VGTNKSLTEE AENWGDGEPN NKKNKEDCVE IYIKRNKDAG KWNDDACHKL KAALCYTASC QPWSCSGHGE CVEIINNYTC NCDVGYYGPQ CQFVIQCEPL
EAPELGTMDC THPLGNFSFS SQCAFSCSEG TNLTGIEETT CGPFGNWSSP EPTCQVIQCE PLSAPDLGIM NCSHPLASFS FTSACTFICS EGTELIGKKK
TICESSGIWS NPSPICQKLD KSFSMIKEGD YNPLFIPVAV MVTAFSGLAF IIWLARRLKK GKKSKRSMND PY
(Fel:77% Bos:75% Rab:82% Mus:71% Rat:72%)
P-selectin:
MANCQIAILY QRFQRVVFGI SQLLCFSALI SELTNQKEVA AWTYHYSTKA YSWNISRKYC QNRYTDLVAI QNKNEIDYLN KVLPYYSSYY WIGIRKNNKT
WTWVGTKKAL TNEAENWADN EPNNKRNNED CVEIYIKSPS APGKWNDEHC LKKKHALCYT ASCQDMSCSK QGECLETIGN YTCSCYPGFY GPECEYVREC
GELELPQHVL MNCSHPLGNF SFNSQCSFHC TDGYQVNGPS KLECLASGIW TNKPPQCLAA QCPPLKIPER GNMICLHSAK AFQHQSSCSF SCEEGFALVG
PEVVQCTASG VWTAPAPVCK AVQCQHLEAP SEGTMDCVHP LTAFAYGSSC KFECQPGYRV RGLDMLRCID SGHWSAPLPT CEAISCEPLE SPVHGSMDCS
PSLRAFQYDT NCSFRCAEGF MLRGADIVRC DNLGQWTAPA PVCQALQCQD LPVPNEARVN CSHPFGAFRY QSVCSFTCNE GLLLVGASVL QCLATGNWNS
VPPECQAIPC TPLLSPQNGT MTCVQPLGSS SYKSTCQFIC DEGYSLSGPE RLDCTRSGRW TDSPPMCEAI KCPELFAPEQ GSLDCSDTRG EFNVGSTCHF
SCNNGFKLEG PNNVECTTSG RWSATPPTCK GIASLPTPGL QCPALTTPGQ GTMYCRHHPG TFGFNTTCYF GCNAGFTLIG DSTLSCRPSG QWTAVTPACR
AVKCSELHVN KPIAMNCSNL WGNFSYGSIC SFHCLEGQLL NGSAQTACQE NGHWSTTVPT CQAGPLTIQE ALTYFGGAVA STIGLIMGGT LLALLRKRFR
QKDDGKCPLN PHSHLGTYGV FTNAAFDPSP (Can:65% Bos:60% Mus:63% Rat:64%)
|
| → 【R】 Regucalcin | |
| Serotonin (別名:5-Hydroxytryptamine:5-HT, Enteramine) | |
|---|---|
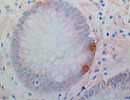 Serotonin 結腸 X400 |
Serotoninは90%以上が腸管のクロム親和性細胞(エンテロクロマフィン enterochromaffin細胞)で、数%が脳のニューロン、松果体でトリプトファンから合成される分子量176のインドールアミンで、5-hydroxytryptamine(5-HT)という。神経伝達物質として睡眠、行動、記憶などの活動に関与するほか血管平滑筋収縮、消化管機能の調節、血小板凝集にも関係する。またGHの分泌を促進し、LH、TSHの分泌を抑制する。血中(血清Sera中から発見されたのがSerotoninの名の由来となっている)に放出され、肝で代謝されて5-hydroxyindole acetic acid (5-HIAA) となり排泄される。また血中で血小板中に蓄積され、血小板活性化因子などにより放出される。消化管の内分泌細胞癌ではSerotonin陽性例が多いという報告がある。(消化器内視鏡7:275-284,1995) ホルマリン固定組織でも可能。Ratにも交差。 |
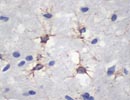 5-HT2A 脳 凍結 X400 |
セロトニン(5-HT)の受容体は単一の分子ではなく、5-HT1〜7など10数種類がある。(例えば、「5-HT受容体1A」とは呼ばずに「5-HT1A受容体」とか、単に「5-HT1A」というように表現される)これらは遺伝子や一次構造、生体内の分布、細胞内の情報伝達の方法、リガンドとの親和性や結合部位に若干の違いがあるが、ほとんどはG蛋白共役型の7回膜貫通型と呼ばれる受容体でセロトニンを共通のリガンドとする。5-HT2A受容体(Gene:13q14.3;HTR2A ,52.6kD,471aa)は血管平滑筋、血小板、肺、中枢神経、消化管にみられ、セロトニンとの結合により血小板凝集、平滑筋収縮、神経興奮作用を示す。なお、外因性リガンドとしてLSD(Lysergic acid diethylamide)とも結合する。凍結切片でのみ反応。 (リストより削除) |
MDILCEENTS LSSTTNSLMQ LNDDTRLYSN DFNSGEANTS DAFNWTVDSE NRTNLSCEGC LSPSCLSLLH LQEKNWSALL TAVVIILTIA GNILVIMAVS LEKKLQNATN YFLMSLAIAD MLLGFLVMPV SMLTILYGYR WPLPSKLCAV WIYLDVLFST ASIMHLCAIS LDRYVAIQNP IHHSRFNSRT KAFLKIIAVW TISVGISMPI PVFGLQDDSK VFKEGSCLLA DDNFVLIGSF VSFFIPLTIM VITYFLTIKS LQKEATLCVS DLGTRAKLAS FSFLPQSSLS SEKLFQRSIH REPGSYTGRR TMQSISNEQK ACKVLGIVFF LFVVMWCPFF ITNIMAVICK ESCNEDVIGA LLNVFVWIGY LSSAVNPLVY TLFNKTYRSA FSRYIQCQYK ENKKPLQLIL VNTIPALAYK SSQLQMGQKK NSKQDAKTTD NDCSMVALGK QHSEEASKDN SDGVNEKVSC V |
 CD15s 結腸癌 X400 |
シアル酸を含む糖鎖抗原で、白血球表面抗原であるCD15がシアル化したものであり、CA19-9と同様にSelectinのリガンドとして炎症などで活性化された白血球と血管内皮細胞との接着の初期段階に関与する。またLewis血液型物質であるLexがシアル化したものでもあり、正常組織では気管支、腎尿細管、胃腺、大腸腺の一部に陽性のことがある。腫瘍では肺や消化管などの腺癌で陽性のことが多いほか、肝癌や卵巣癌にも陽性のものがある。(白血球のCD15と消化管をはじめとする上皮細胞のLexとは抗原としては同じなのだが、それぞれ別のフコース転位酵素により合成されているらしい。)なおCA19-9(sLeA)が1型糖鎖(Galβ1, 3GlcNAc)に由来するのに対し、sLexは2型糖鎖(Galβ1,4GlcNAc)に由来する。ホルマリン固定組織でも反応は良好。 (リストより削除しました) |
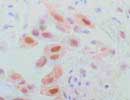 STAT3 肺癌 ×400 |
STATはサイトカイン刺激によって引き起こされる様々な遺伝子発現を誘導する転写因子で、およそ100kDa,750-850aaの蛋白のグループ。分子中央部にDNA結合部位(STAT2を除く)、N末端側にロイシンジッパーと呼ばれる部分、C末端近くにチロシン残基を有する構造をしている。ILやIFNなどのサイトカインが受容体に結合することによって活性化したJanus kinase(JAK)によりこのチロシン残基がリン酸化されると二量体を形成した後、核内に移行し転写因子として働く。STATには7種類があり、STAT3は約95kD,770aaの蛋白で、Geneは17q21.2。ほぼ全組織に分布し、特にIL-6やEGF、GM-CSFなどのサイトカインにより活性化され、acute-phase response factor(APRF)とも呼ばれる。ホルマリン固定組織でも核及び細胞質に反応する。 (現在、リストより削除しています。) |
MAQWNQLQQL DTRYLEQLHQ LYSDSFPMEL RQFLAPWIES QDWAYAASKE SHATLVFHNL LGEIDQQYSR FLQESNVLYQ HNLRRIKQFL QSRYLEKPME IARIVARCLW EESRLLQTAA TAAQQGGQAN HPTAAVVTEK QQMLEQHLQD VRKRVQDLEQ KMKVVENLQD DFDFNYKTLK SQGDMQDLNG NNQSVTRQKM QQLEQMLTAL DQMRRSIVSE LAGLLSAMEY VQKTLTDEEL ADWKRRQQIA CIGGPPNICL DRLENWITSL AESQLQTRQQ IKKLEELQQK VSYKGDPIVQ HRPMLEERIV ELFRNLMKSA FVVERQPCMP MHPDRPLVIK TGVQFTTKVR LLVKFPELNY QLKIKVCIDK DSGDVAALRG SRKFNILGTN TKVMNMEESN NGSLSAEFKH LTLREQRCGN GGRANCDASL IVTEELHLIT FETEVYHQGL KIDLETHSLP VVVISNICQM PNAWASILWY NMLTNNPKNV NFFTKPPIGT WDQVAEVLSW QFSSTTKRGL SIEQLTTLAE KLLGPGVNYS GCQITWAKFC KENMAGKGFS FWVWLDNIID LVKKYILALW NEGYIMGFIS KERERAILST KPPGTFLLRF SESSKEGGVT FTWVEKDISG KTQIQSVEPY TKQQLNNMSF AEIIMGYKIM DATNILVSPL VYLYPDIPKE EAFGKYCRPE SQEHPEADPG SAAPYLKTKF ICVTPTTCSN TIDLPMSPRT LDSLMQFGNN GEGAEPSAGG QFESLTFDME LTSECATSPM |
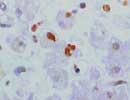 ssDNA 肝 X400X1.4 |
Apoptosisの結果EndonucleaseによるDNAの断片化が起こった断端部(nick end)の一本鎖となったDNAを免疫組織化学的に検出する。そのLabelling IndexでのTUNELの相関は r =0.6613(p<0.0001)との報告がある。(Watanabe,et al. "Detection of Apoptotic cells in Human Colorectal Cancer by Two Different in situ methods:Antybody against Single-stranded DNA and Terminal Deoxynucleotidyl Transferase-mediated dUTP-biotin Nick End-labelling Methods": Jpn.J.Cancer Res,90;188-193,1999) ホルマリン固定組織で特別な処理を要さずとも核内に反応が得られる。左図では形の歪んだ核や丸く小さく破断した核に強い陽性所見が見られる。(なお、左図は400倍で撮影した画像をさらに1.4倍している) (抗体補充の目途が立たなくなったためリストより削除しました) |
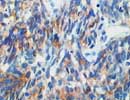 SCLC 肺癌 X400 |
肺小細胞癌関連抗原のCluster Iに相当する125〜145kDの膜抗原を認識するが、NCAM(CD56)と抗原が共通している可能性がある。また小細胞癌以外の肺癌でも稀に反応することがあると言われる。ホルマリン固定では染まりにくいことがあるが、熱処理が有効なことがあるほか、硫酸亜鉛をホルマリン固定液に2%加えると抗原性の保持が良いと言われる。(病理と臨床,Vol.9,p236,1991) 95%アルコール固定された細胞診材料でも良く反応し(NSEよりも綺麗に染まる)、胸水などでの小細胞癌の確認に有用。 (リストより削除しました) |
| Somatostatin (別名:Somatotropin-release-inhibiting factor:SRIF,GH-inhibiting hormone[factor]:GIH,GIF) | |
|---|---|
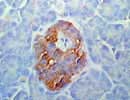 Somatostatin 膵 ×400 |
膵ラ島のδ細胞のほか胃、腸管、脳などで産生される環状ペプチドホルモン(Gene:3q28;SST)。成長ホルモン放出抑制ホルモン(SRIF)とも呼ばれるように下垂体前葉、膵、腸などに対して成長ホルモン、プロラクチン、インシュリン、グルカゴン、ガストリン、セクレチンなどのホルモンの分泌を抑制する作用を示す。また肥満細胞の脱顆粒を促進したり、Tリンパ球の増殖を抑制する作用もある。SubstancePやカテコールアミンなどにより分泌が促進される。12.7kD,116aaの前駆体からアミノ酸数の異なるS-14(14aa;103-116),S-28(28aa;89-116)のペプチドになる。機能性の下垂体腺腫、膵島細胞腫などで増加し、ブアンまたはホルマリン固定組織での検索が一般的。 |
MLSCRLQCAL AALSIVLALG CVTGAPSDPR LRQFLQKSLA AAAGKQELAK YFLAELLSEP NQTENDALEP EDLSQAAEQD EMRLELQRSA NSNPAMAPRE RKAGCKNFFW KTFTSC (S28:89-116,S14:103-116) |
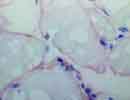 Spectrin 骨格筋 X400凍結 |
SpectrinはDystrophinと共通した構造を有する細胞膜の「裏打ち蛋白」で、Erythrocyte spectrinとnon-erythroid spectrin(Fodrin)とがある。α鎖とβ鎖からなり、通常α鎖とβ鎖が逆方向によじれあって二量体を形成し、さらにそれが2個ずつ結合して四量体を構成している。またβ鎖のN末端側のactin結合ドメインで短いアクチンフィラメントと結合して細胞膜直下に二次元の網目構造を形成し、さらに赤血球では膜貫通蛋白であるGlycophorin Aと結合することによって細胞膜を緊張させ赤血球の形態を保持している。本抗体(SPEC1,SPEC2とも)は赤血球及び骨格筋のβ-spectrin(253kD,2137aa,Gene:14q23-q22;SPTB1 )を認識するがホルマリン固定組織では反応しない。なお、SPEC2はRat,Mouse,Rabbitなどとわずかに交差する。 (リストより削除しました。) |
TSATEFENVG NQPPYSRINA RWDAPDDELD NDNSSARLFE RSRIKALADE REVVQKKTFT KWVNSHLARV SCRITDLYKD LRDGRMLIKL LEVLSGEMLP KPTKGKMRIH CLENVDKALQ FLKEQRVHLE NMGSHDIVDG NHRLVLGLIW TIILRFQIQD IVVQTQEGRE TRSAKDALLL WCQMKTAGYP HVNVTNFTSS WKDGLAFNAL IHKHRPDLID FDKLKDSNAR HNLEHAFNVA ERQLGIIPLL DPEDVFTENP DEKSIITYVV AFYHYFSKMK VLAVEGKRVG KVIDHAIETE KMIEKYSGLA SDLLTWIEQT ITVLNSRKFA NSLTGVQQQL QAFSTYRTVE KPPKFQEKGN LEVLLFTIQS RMRANNQKVY TPHDGKLVSD INRAWESLEE AGYRRELALR NELIRQEKLE QLARRFDRKA AMRETWLNEN QRLVAQDNFG YDLAAVEAAK KKHEAIETDT AAYEERVRAL EDLAQELEKE NYHDQKRITA RKDNILRLWS YLQELLQSRR QRLETTLALQ KLFQDMLHSI DWMDEIKAHL LSAEFGKHLL EVEDLLQKHK LMEADIAIQG DKVKAITAAT LKFTEGKGYQ PCDPQVIQDR MSHLEQCFEE LSNMAAGART QLEQSKRLWK FFWEMDEAES WIKEKEQIYS SLDYGKDLTS VLILQRKHKA FEDELRGLDA HLEQIFQEAH GMVARNEFGH PQIEARIKEV SAQWDQLKDL AAFCKKNLQD AENFFQFQGD ADDLKAWLQD AHRLLSGEDV GQDEGATRAL GKKHKDFLEE LEESRGVMEH LEQQAQGFPE EFRDSPDVTH RLQALRELYQ QVVAQADLRQ QRLQEALDLY TVFGETDACE LWMGEKEKWL AEMEMPDTLE DLEVVQHRFD ILDQEMKTLM TQIDGVNLAA NSLVESGHPR SREVKQYQDH LNTRWQAFQT LVSERREAVD SALRVHTLCV DCEETSKWIT DKTKVVESTK DPGRDLAGII AIQRKLSGLE RDVAAIQARV DALERESQQL MDSHPEQKEN IGQRQKHLEE LWQGLQQSLQ GQEDLLGEVS QLQAFLQDLD DFQAWLSITQ KAVASEDMPE SLPEAEQLLQ QHAGIKDEID GHQDSYQRVK ESGEKVIQGQ TDPEYLLLGQ RLEGLDTGWD ALGRMWESRS HTLAQCLGFQ EFQKDAKQAE AILSNQEYTL AHLEPPDSLE AAEAGIRKFE DFLGSMENNR DKVLSPVDSG NKLVAEGNLY SDKIKEKVQL IEDRHRKNNE KAQEASVLLR DNLELQNFLQ NCQELTLWIN DKLLTSQDVS YDEARNLHNK WLKHQAFVAE LASHEGWLEN IDAEGKQLMD EKPQFTALVS QKLEALHRLW DELQATTKEK TQHLSAARSS DLRLQTHADL NKWISAMEDQ LRSDDPGKDL TSVNRMLAKL KRVEDQVNVR KEELGELFAQ VPSMGEEGGD ADLSIEKRFL DLLEPLGRRK KQLESSRAKL QISRDLEDET LWVEERLPLA QSADYGTNLQ TVQLFMKKNQ TLQNEILGHT PRVEDVLQRG QQLVEAAEID CQDLEERLGH LQSSWDRLRE AAAGRLQRLR DANEAQQYYL DADEAEAWIG EQELYVISDE IPKDEEGAIV MLKRHLRQQR AVEDYGRNIK QLASRAQGLL SAGHPEGEQI IRLQGQVDKH YAGLKDVAEE RKRKLENMYH LFQLKRETDD LEQWISEKEL VASSPEMGQD FDHVTLLRDK FRDFARETGA IGQERVDNVN AFIERLIDAG HSEAATIAEW KDGLNEMWAD LLELIDTRMQ LLAASYDLHR YFYTGAEILG LIDEKHRELP EDVGLDASTA ESFHRVHTAF ERELHLLGVQ VQQFQDVATR LQTAYAGEKA EAIQNKEQEV SAAWQALLDA CAGRRTQLVD TADKFRFFSM ARDLLSWMES IIRQIETQER PRDVSSVELL MKYHQGINAE IETRSKNFSA CLELGESLLQ RQHQASEEIR EKLQQVMSRR KEMNEKWEAR WERLRMLLEV CQFSRDASVA EAWLIAQEPY LASGDFGHTV DSVEKLIKRH EAFEKSTASW AERFAALEKP TTLELKERQI AERPAEETGP QEEEGETAGE APVSHHAATE RTSPVSLWSR LSSSWESLQP EPSHPY (Mus:87% Rat:86%) |
| Squamous cell carcinoma (related) antigen2 (SCC2,SCCA2) (別名:SerpinB4) | |
|---|---|
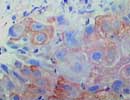 SCC 肺癌 ×400 |
所謂「SCC抗原」とは、1977年に加藤らによって子宮頸部扁平上皮癌の組織中から抽出されたTA-4(tumor antigen-4の意味らしい)抗原の亜分画のひとつで、一般に390aa、分子量約45000、等電点6.6の蛋白をいうが、最近の研究では中性のSCCA1と酸性のSCCA2とが分離されており、特にSCCA2が扁平上皮癌に特異性が高いと言われている。ともにC末端側にserin protease inhibitor (serpin)構造を持ちプロテアーゼ阻害作用を有し、遺伝子座もやはりserpinであるMaspin遺伝子の付近(18q21.3)。またSCCは、皮膚に重層構造を有さない鳥類以下の脊椎動物ではみられないことから、重層扁平上皮の層構成に関係していると考えられている。ホルマリン固定組織でも反応可。 |
MNSLSEANTK FMFGLFQQFR KSKENNIFYS PISITSALGM VLLGAKDNTA QQISKILHFD QVTENTTEKA ATYHVDRSGN VHHQFQKLLT EFNKSTDAYE
LKIANKLFGE KTYQFLQEYL DAIKKFYQTS VESTDFANAP EESRKKINSW VESQTNEKIK NLFPDGTIGN DTTLVLVNAI YFKGQWENKF KKENTKEEKF
WPNKNTYKSV QMMRQYNSFN FALLEDVQAK VLEIPYKGKD LSMIVLLPNE IDGLQKLEEK LTAEKLMEWT SLQNMRETCV DLHLPRFKME ESYDLKDTLR
TMGTVNIFNG DADLSGMTWS HGLSVSKVLH KAFVEVTEEG VEAAAATAVV VVELSSPSTN EEFCCNHPFL FFIRQNKTNS ILFYGRFSPP
(Rab65% Bos62% Mus59% Rat51% Sus48%)
|
抗体の用途外使用
消毒用アルコールを飲用に用いる人はいないように、どんな製品でも指定された用途・用法を守るのが原則であるが、どうしても免疫組織化学用の抗体が入手できない場合は、とりあえず入手可能な抗体を応用できないか試してみることもある。 ELISA法やサンドイッチ法によるEIAなどはかなり感度の高い抗原検出法であるのに対して免疫組織化学(IHC)は感度の低い検出法であり、 Western blotting(WB)や Immunoprecipitation(IP)法に比べても低いこともある。まして固定操作が加わった材料ではなおさらである。勿論、IHC用に調整された抗体を使用することがベストであるが、他の用途の抗体でも基本的に同じ抗原抗体反応であるのだから、(少なくとも新鮮凍結切片には)IHCでの応用は全く不可能とは言えない。しかし、問題はタイター(力価)の設定であり、メーカーが条件を指定している場合は別として、(問合せても「データがない」といわれることが多い!)一般にELISA法用のものなどは調整が難しく、使用できてもかなり反応が弱くてTyramideなどを使った増感法を用いないと可視的な反応が得られないことも多い。市販抗体の中で最も多いWB法用抗体の場合は応用可能なことが多く(一概には言えないが)大体5〜20倍ほど濃度を上げた(希釈率を下げた)あたりを目安として濃度を変えて予備試験を行い至適条件を探っていくことになる。ただし、メーカー指定の用法ではないのだからたとえ上手くいかなくともユーザーの自己責任(経済的犠牲)は覚悟する必要がある。(一般にIHC用の抗体、特にホルマリン固定組織用の抗体が他の用途指定の抗体より価格が高いのにはこういう点もあるのだろうが...) |
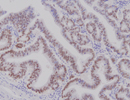 SOX9 ×200 |
SOX9(SRY-box transcription factor 9)は、大部分の哺乳類における性(雄性)決定遺伝子であるY染色体短腕(Yp11.2)に位置する遺伝子 SRY (Sex-determining region Y、 Testis determining factor:TDFとも呼ばれる)のファミリーに属する509aa、約56kDaの転写因子で、遺伝子は17q24.3にある。 性の分化のほか軟骨細胞の分化に関与しており、変異により先天性骨軟骨形成異常(Campomelic dysplasia)が起きるところから CMD1またはCMPD1とも呼ばれる。。 (リスト非掲載です) |
MNLLDPFMKM TDEQEKGLSG APSPTMSEDS AGSPCPSGSG SDTENTRPQE NTFPKGEPDL KKESEEDKFP VCIREAVSQV LKGYDWTLVP MPVRVNGSSK NKPHVKRPMN AFMVWAQAAR RKLADQYPHL HNAELSKTLG KLWRLLNESE KRPFVEEAER LRVQHKKDHP DYKYQPRRRKSVKNGQAEAE EATEQTHISP NAIFKALQAD SPHSSSGMSE VHSPGEHSGQ SQGPPTPPTT PKTDVQPGKA DLKREGRPLP EGGRQPPIDFR DVDIGELSS DVISNIETFD VNEFDQYLPP NGHPGVPATH GQVTYTGSYG ISSTAATPAS AGHVWMSKQQ APPPPPQQPP QAPPAPQAPP QPQAAPPQQP AAPPQQPQAH TLTTLSSEPG QSQRTHIKTE QLSPSHYSEQ QQHSPQQIAY SPFNLPHYSP SYPPITRSQY DYTDHQNSSS YYSHAAGQGT GLYSTFTYMN PAQRPMYTPI ADTSGVPSIP QTHSPQHWEQ PVYTQLTRP |
| Gene:12q22-q24。一般にヒト造血幹細胞(増殖)因子(SCF)と呼ばれるが、Mast cell growth factor(MGF)とも呼ばれ、未分化血液細胞の他、色素細胞、生殖細胞の分化・増殖に共通して働く因子で、 骨髄や精巣・卵巣などの間質細胞の表面に認められる膜結合型(I型膜貫通蛋白,Homodimer)と、これらの細胞から「分泌」され c-kitをレセプターとして血液幹細胞などに結合する遊離型とがある。 他に線維芽細胞、胎盤、脳・肝・腎・肺などにも発現がみられ、また、HeLa細胞など一部の腫瘍においても認められている。なお、本抗体(Clone:SCF235ハイブリドーマ細胞培養上清由来)は膜結合型、遊離型両方と反応する。 (リストより削除しました。) | |
MKKTQTWILT CIYLQLLLFN PLVKTEGICR NRVTNNVKDV TKLVANLPKD YMITLKYVPG MDVLPSHCWI SEMVVQLSDS LTDLLDKFSN ISEGLSNYSI IDKLVNIVDD LVECVKENSS KDLKKSFKSP EPRLFTPEEF FRIFNRSIDA FKDFVVASET SDCVVSSTLS PEKDSRVSVT KPFMLPPVAA SSLRNDSSSS NRKAKNPPGD SSLHWAAMAL PALFSLIIGF AFGALYWKKR QPSLTRAVEN IQINEEDNEI SMLQEKEREF QEV (26-273) |
| Substance-P | |
|---|---|
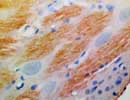 Substance-P 神経節 ×400 |
Substance Pは Neurokinin類に属するアミノ酸10〜12個の小さな直鎖ペプチドで、その陽性部位は視床下部など中枢神経系に広く分布するほか、末梢神経、副腎髄質などにも見られる。中枢神経系、血管平滑筋などに受容体が存在し、ニューロンに対して興奮作用を示す神経伝達物質であるほか、白血球遊走や貪食細胞の活性化、平滑筋収縮、血圧低下、血管拡張、腎血流増加、利尿作用、唾液分泌、下垂体ではGHやPRL分泌促進、ACTH分泌抑制、膵ではインスリン分泌抑制など多彩な作用を示す。 SubstancePはSubstanceK(NeurokininA)と遺伝子(7q21.3-22.1,Tachykinin precursor1:TAC1 )が同じで、mRNA段階でそれぞれの前駆体(α-Preprotachykinin:PPTとβ-PPT)を含む4つ(或いは6つとも)のisoformに分かれるといわれている。 |
MKILVALAVF FLVSTQLFAE EIGANDDLNY WSDWYDSDQI KEELPEPFEH LLQRIARRPK PQQFFGLMGK RDADSSIEKQ VALLKALYGH GQISHKRHKT DSFVGLMGKR ALNSVAYERS AMQNYERRR (58-68:SubstanceP,98-107:NeurokininA) |
| (Lung) Surfactant (apo)protein A (SP-A) (別名:COLLEC4/5) | |
|---|---|
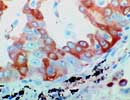 SP-A 肺癌 ×400 |
II型肺胞上皮細胞とクララ細胞からは肺サーファクタントと呼ばれる一種の界面活性剤が分泌され、末梢気道の閉塞を防止する働きをしている。サーファクタントの主成分はリン脂質であるが、これに特異的なアポ蛋白(surfactant apoproteinあるいはsurfactant protein:SP)が結合し複合体となっている。 SPにはA〜Dの4種類が知られているが、SP-A(Gene:10q22.2-q23.1)は分子量34-37kDの蛋白またはその二量体で、サーファクタントの表面張力を低下させその活性を調節するほか、コラーゲン様の三本鎖螺旋構造を持ちレクチン作用を示すところから「コレクチン」(Collectin=Collagen+Lectinの造語)とも呼ばれ、細菌などに結合しマクロファージの食作用を強めるなど感染防御にも関係していると考えられている。 肺癌におけるII型肺胞上皮細胞、クララ細胞への分化マーカーとして利用される。ホルマリン固定組織でもよく染まる。 (2020.5.14 cloneを変更しました) |
| Survivin (別名:IAP4,BIRC5) | |
|---|---|
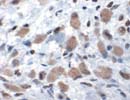 SVV 虫垂癌 ×400 |
Survivin(SVV)は16.4kD、142aaの蛋白で遺伝子は17q25;BIRC5。主にTNFに誘導される経路でCaspaseの活性を阻害するapoptosis抑制蛋白(inhibitor of apoptosis proteins:IAP)ファミリーに属し、IAP4あるいはAIP4とも呼ばれる。 また、昆虫に感染するBaculovirusのp35蛋白N末端側のBaculoviral IAP repeat(BIR)モチーフと呼ばれる70残基ほどのアミノ酸の繰り返し構造を有し、BIR-containing protein 5(BIRC5)とも呼ばれる。G2/M期に発現し有糸分裂に関与すると考えられているが、通常は精巣や胸腺を除き、少なくとも免疫組織化学的に検出できるほどの発現はみられない。 胎生期では腎、肝、肺、脳などの各組織で発現し、また肺、胃、膵、大腸、乳腺、前立腺などの腺癌や一部の脳腫瘍、悪性リンパ腫など多くの腫瘍で過剰発現が報告されており、その発現と予後や化学療法抵抗性との相関が確認されている。ホルマリン固定組織でも染色可。通常核に染まるが細胞質にも弱く染まることもある。染色性が弱い時には熱処理が有効。マウスsurvivinにも交差する。 |
MGAPTLPPAW QPFLKDHRIS TFKNWPFLEG CACTPERMAE AGFIHCPTEN EPDLAQCFFC FKELEGWEPD DDPIEEHKKH SSGCAFLSVK KQFEELTLGE FLKLDRERAK NKIAKETNNK KKEFEETAKK VRRAIEQLAA MD |
| Synaptophysin | |
|---|---|
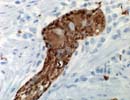 Synaptophysin 結腸 X400 |
SynaptophysinはMajor synaptic vesicle protein p38とも呼ばれるように神経細胞のシナプス小胞 (presynaptic vesicle)の膜に局在(作られるのは細胞体)するカルシウム結合性の33.8kD,313aaの膜糖蛋白(Gene:Xp11.23-p11.22;SYP)で、副腎髄質、下垂体、膵などの神経・神経内分泌細胞の細胞質に見られる他、腫瘍では Neuroblastoma,Ganglioneuroblastoma,Pheochromocytoma,Paragangliomaや下垂体腺腫、膵、甲状腺などの neuroendocrine carcinomaに広い範囲で反応が見られる。神経内分泌細胞に対しては分泌顆粒の乏しいものにも反応する反面、特異性はChromogranin Aよりも低いといわれ、またホルマリンの過剰固定により陰性化しやすいので熱処理が必要な場合がある。 |
MLLLADMDVV NQLVAGGQFR VVKEPLGFVK VLQWVFAIFA FATCGSYSGE LQLSVDCANK TESDLSIEVE FEYPFRLHQV YFDAPTCRGG TTKVFLVGDY SSSAEFFVTV AVFAFLYSMG ALATYIFLQN KYRENNKGPM LDFLATAVFA FMWLVSSSAW AKGLSDVKMA TDPENIIKEM PVCRQTGNTC KELRDPVTSG LNTSVVFGFL NLVLWVGNLW FVFKETGWAA PFLRAPPGAP EKQPAPGDAY GDAGYGQGPG GYGPQDSYGP QGGYQPDYGQ PAGSGGSGYG PQGDYGQQGY GPQGAPTSFS NQM |
| Syndecan-1 (CD138) | |
|---|---|
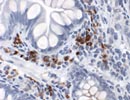 Synd-1 小腸 X400 |
SyndecanはI型細胞膜貫通糖蛋白で、ヘパラン硫酸(Heparan sulfate:HS)を含む膜型Proteoglycan(HSPG)である。接着分子としてCollagenI,III,VやFibronectinなどの細胞外基質(ECM)と結合する他、FGFのco-receptorとして働き、細胞内ドメインの4個のチロシン残基のいずれかがリン酸化されることにより細胞内情報伝達にも関与する。Syndecanファミリーには4種類(Syndecan-1, Syndecan-2/Fibroglycan:23kD, Syndecan-3/N-syndecan:43kD,Syndecan-4/Ryudocan/Amphyglycan:22kD)が知られており、いずれも膜貫通部と細胞質内ドメインの相同性が高い。Syndecan-1(33kD,Gene:2p24.1;SDC1 )は、白血球系ではPreB cellや形質細胞にみられ、CD138に分類されているほか上皮細胞、血管平滑筋、神経細胞などの表面にもみられる。なお、緑膿菌はSyndecan-1のコア蛋白を切断し細胞外ドメインを遊離させることが知られている。ホルマリン固定組織では熱処理が有効。 |
MRRAALWLWL CALALSLQPA LPQIVATNLP PEDQDGSGDD SDNFSGSGAG ALQDITLSQQ TPSTWKDTQL LTAIPTSPEP TGLEATAAST STLPAGEGPK EGEAVVLPEV EPGLTAREQE ATPRPRETTQ LPTTHQASTT TATTAQEPAT SHPHRDMQPG HHETSTPAGP SQADLHTPHT EDGGPSATER AAEDGASSQL PAAEGSGEQD FTFETSGENT AVVAVEPDRR NQSPVDQGAT GASQGLLDRK EVLGGVIAGG LVGLIFAVCL VGFMLYRMKK KDEGSYSLEE PKQANGGAYQ KPTKQEEFYA (18-310) |