組織検査(組織診断)
最終更新日:2015.06.15
組織検査(組織診断)
病変部を含む組織から組織標本を作製し、それを顕微鏡で観察してその病変を解析する検査・試験方法です。
標本の作製や特殊な染色等の技術的なプロセスは「臨床検査技師」、診断は「認定病理医・専門医」という資格を持つ者が主に行います。
| [材料]Specimens (Sampling) | |
|---|---|
| 外科的手術で摘出された臓器や比較的大きな組織、診断目的に採取される小さな組織片(「生検」と呼ばれます)などがその主な材料となります。また病気で亡くなられた方の体から病理解剖によって取り出された臓器(「剖検」と呼ばれます)や実験動物の組織なども対象となります。 「生検」にも、胃や腸などの内視鏡検査などの際に遠隔操作ができる小さな鉗子を使って体の中から組織を摘み取ってくる「パンチバイオプシー」という方法や、特別な針を体の外から刺して組織を取ってくる「針生検」、子宮内膜や瘻孔などから組織を掻き出したり(掻爬といいます)皮膚・筋肉など比較的体の表面に近い部分からメスで組織を切り取る「試験切除」など様々な方法があります。 |
|
| [固定]Fixation | |
|---|---|
| 生体から切り離された組織や細胞はそのままでは死んでしまいますが、その時に細胞の形や組織の構造が変化してしまったり、いろいろな成分が失われることがあります。それを防ぎ生体中にあった時の状態にできるだけ近い状態のまま保存するために「固定」という操作が行われます。 固定法としては、一般的には10%緩衝ホルマリン液に漬けて固定する方法(浸漬固定)が広く用いられていますが、ほかに目的によってアルコールやある種の酸などを成分とする各種の固定液が使用されます。また、固定処理ができないような場合には組織を急速凍結する方法や生のまま薄く切る方法もあります。 | |
| [脱灰、脱脂]Decalcification | |
|---|---|
 高周波利用設備許可番号 近高第1001763号 |
カルシウム(石灰分)や脂肪を多く含んでいる組織はそのままでは標本にするのが難しい(部分的に切削抵抗が極端に異なると、後から述べる「薄切」が困難になります)ので、一般的には酸などを使った「脱灰」やアルコールなどを使った「脱脂」という処理が必要となります。
蟻酸などの酸を用いる脱灰法は強力で処理に要する時間を短縮できますが、免疫組織化学などでは反応性を損なうことがありますので、EDTA塩などを用いてカルシウムをキレート化する方法を用いることもあります。また、アルコールの脱水作用が組織に影響を与える場合には中性洗剤を用いた脱脂法も使われます。 なお、カルシウムや脂肪自体を検出する必要のある場合は別の方法が用いられます。 |
| [切出し]Trimming | |
|---|---|
 切出し工程 |
一般的な顕微鏡で観察できる大きさには限界があります。また組織が厚いと次に述べる脱水などの処理に用いる薬液が組織内に充分に浸透しませんので、材料が大きい場合には必要な部分を選んで一定の大きさ、厚さ(mm単位)に切出します。 この際、病変部の位置、範囲、形状などを肉眼的によく観察するとともに、写真撮影などを行い詳細な記録を作成することが重要です。 |
| [脱水]Dehydration | |
|---|---|
 密閉陰圧式脱水処理装置 |
後に述べる「包埋」剤はほとんどが非水溶性ですので、組織内に浸透させるためにはあらかじめアルコールなどを用いて組織中の水分を除いておかねばなりません。この際、急速に脱水すると組織が強く収縮してしまうので、一般的には低濃度のアルコールから何時間も掛けて徐々に濃度を上げたアルコールを陰圧下で組織内に浸透させ置換脱水していきます。一連の処理過程の中でもっとも時間を要する部分です。最終的に脱水できたらアルコールとパラフィンの両方と溶け合う中間剤を経てパラフィンを浸透させていきます。 なお、この脱水操作をせずに水分を含んだまま組織を薄切したり、凍結して薄切する技術もあります。 |
| [包埋]Embedding | |
|---|---|
 包理工程 |
生物組織には様々な構造があり場所によって細胞や線維などの密度も異なります。次の「薄切」の工程で試料の塑性変形を防ぎ、作業をスムーズにするためには組織内に隙間なく均一な密度で、一定の抵抗性(硬度)と柔軟性(弾性)を与えることが必要です。そのためパラフィンなどの包埋剤を内部に充分浸透させた後、組織ごと鋳型(モルド)に流し込んで固め、一つの塊(ブロック)にし、プラスチックなどでできた特別な支持台にしっかり貼りつけます。包埋剤として一般的にパラフィンが使用されているのは融点が比較的低い(60℃前後)ので組織に影響を与えるような過剰な熱を加えずに済み、また加工が比較的簡単なうえ、最終的に容易に溶解除去することができるからです。 なお、用途によってはパラフィン以外にエポキシ、メタクリレートなど各種の樹脂を用いて包理することもあります。 |
| [薄切]Sectioning | |
|---|---|
 |
通常、光学顕微鏡で観察するためには標本を光が透過するほどの薄さ(μm=1/1000mm単位)の切片(Section)にしなければなりません。この工程を「薄切」(ハクセツ)と言い、通常はミクロトーム Microtomeという装置に被削材(ブロック)を装着・固定し、鋭利な刃を楔のように当てて削るようにして薄い切片を作ります。この操作は、基本的には切削加工になりますが、単に試料を削るのではなくその形状や構造を忠実に反映した切削片(試料片)を得る必要があります。一連の工程の中でも特に高い技術を要し、人の技能に頼らざるを得ない部分です。 |
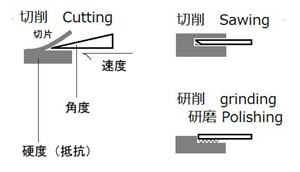 |
※この工程は、基本的には木材や金属の加工技術と同じですが、対象が人を含む貴重な生物試料であるという特殊性から医学・生物学の狭い世界で独自に発展してきたため、少しやり方や用語が異なっています。 Cutting:最も基本的な作製法で、鉋(カンナ)で表面を”削る”イメージ。実は斧(オノ)のように刃先を被削材に食い込ませて”裂く、割る”に近い。切片の状態は刃の角度、衝突速度、試料の硬度(切削抵抗)に影響されるが、あまり硬いものには適さない。 Sawing:鋸(ノコギリ)で”切る”イメージ。実は刃先で”削る”わけで、削り取られた部分だけ試料は消耗しており、切片を重ねても元の大きさにはならない。硬い(弾性の低い)ものに適している。 Lapping:鑢(ヤスリ)で”削る”イメージ。削りながら薄くしていく方法で、試料の損耗が多い。GrindingとかPolishingとも呼ばれ、Sawing後の切り口の仕上げにも用いられるが、慣用的に一括して「研磨標本」と呼ばれている。 |
| こうして作製された切片には薄切時の刃の衝突衝撃・被削材の切削抵抗による収縮や歪み、細かい皺などがあるので、一旦水に浮かせるなどして形を整えてから空気の泡などが入らないように注意しながらガラスに載せ、少し熱を加えて縮みを伸ばす(これを「伸展」といいます)とともにガラスの表面に貼りつけます。この後充分に乾燥させて再び水分を完全に除きます。なお、切片がガラスから剥離しないように接着剤を用いることもあります。 | |
■ ミクロトーム ■ |
| 「切断」を意味するラテン語のtomosが語源らしいが、トーム(tome)とは「切断器具(刃)」や(切断された)「部分」の意味で、つまり「ミクロトーム(Microtome)」とは「ミクロの切断器具」という意味になります。刃には鋼鉄刀を研磨して刃付けしたもの(Knife)と、薄いスチール鋼にコーティング加工したもの(Blade:使い捨てタイプ)とがありますが、ミクロトームはこれらの刃を装着して顕微鏡標本用に試料(被削材)を薄切するための装置のことを指し、固定した試料台に対して刃を移動させる「滑走式」(ユング型とかシャンツェ型とも呼ばれる)と、固定した刃に対して試料台の方を動かす「回転式」(ロータリー式、ミノー型あるいはザリトリウス型とも呼ばれる)の2つの形式に分類されます。それぞれ長所と短所がありますが、外国では回転式が多いのに対して日本では伝統的に滑走式の方がよく使用されています。その他に、用途や試料によって次のような各種の装置を使い分けます。 |
 |
滑走式ミクロトーム(Sliding microtome, "Sledge microtome") 本邦ではごく一般的なミクロトームで、試料台の移動(試料送り)レールと刃の移動レールがあり、手前側に刃を滑走させて試料を切る。 このタイプは滑走中の刃の浮揚を防ぐ重りがついたものや、滑走レールを挟み込むようにして刃を保持するタイプ、試料送りに傾斜角を利用しないタイプ、安全性や切削屑の可動部への付着防止用のガード板がゴチャゴチャ付いたタイプなどバリエーションがある。 |
 |
回転式ミクロトーム(Rotary microtome) ハンドルの回転運動をカムによって試料台の往復水平運動に変換し、1往復ごとに試料台を垂直に機械送りするタイプ。刃の運動距離(ストローク)は一般に短く大型試料には適さないほか、切削速度の微妙な感覚的調整には限界があるが、刃を固定・保持しており、機械的な連続作業に適しているので、切削抵抗の高い試料や、ひとつの試料から連続的、段階的に多数の切片(Serial sectionやStep sectionなど)を作製する作業に向いている。 |
 |
ビブラトーム(Vibrating microtome, "Vibratome", "Microslicer") 刃を細かく振動させて試料を切る(振動切削)ためビブラ(バイブラ)トームと呼ばれるが、「マイクロスライサー」とも呼ばれる。 固定、脱水や凍結などの人為的操作を加えずに切片を作製できるが、試料は弾性、粘性、剛性により限定される。作製した切片は20〜50μm(0.02〜0.05mm)と少し厚めになるので、いわゆる「Free floating section」として、直接染色液に浸漬して染色することが多い。 |
 |
ウルトラミクロトーム(Ultramicrotome) 透過型電顕用のÅ(オングストローム:1/10000μm)単位の「超薄切片」Ultra-thin sectionを作製する装置で、 切片があまりに薄いため試料観察用の実体顕微鏡がついているのが特徴。 刃は金属ではなく、ガラス(割断面の鋭いエッジを利用)、サファイア、ダイヤモンドなどを使用するので刃の維持コストの高さと、刃渡り(薄切可能面積)の狭さが欠点。薄切厚が非常に薄いため試料送りには機械式のほか、金属の熱膨張を利用するものがある。 |
 |
クライオミクロトーム(Cryomicrotome, "Cryotome", "Cryostat") 本邦やドイツ語圏ではクリオスタットと言う名で呼ばれることも多いが、Cryo-(クライオまたはクリオ)は凍結や低温を示す接頭語で、その名の通り凍結させた試料用の装置で、これを用いて作製した標本を特に「凍結切片」と呼ぶ。ホルマリンによる固定操作や有機溶媒などを避けて標本を作る時に使用される。冷凍庫の中に回転式ミクロトームを組み込んだような構造になっており、試料の状態に合わせて-15℃〜-25℃くらいの温度で使用する。 |
 |
ゼーゲトーム(Saw microtome, [独]"Säge-Schliff") 非脱灰骨、歯、金属、プラスチックなどの硬試料の薄切に用いる装置。 試料をアクリル系樹脂などで固めた後、潤滑剤を加えながらダイヤモンド砥粒加工された刃を高速で回転させて薄切する。ゼーゲ(Eine Säge)とはドイツ語で”ノコギリ”の意味で、原理的には切削よりも研削になる。刃厚幅だけ試料を損耗すること、回転刃のため刃渡りの限界から試料の大きさに制限があること、高価(1枚30万円!)な刃が摩耗しやすいのが欠点。 |
 |
ラッパー,グラインダー(Lapping machine, "Grinder", "Polisher") 研磨剤あるいは研磨布と共に研磨盤(定盤)をグラインダーのように回転させて、試料の両面から徐々に薄くしていく方法をラッピング("wrap"ではなく、"lap")と言い、ミリング(mill)と呼ばれることもある。 このような加工法で作製された標本を特に「研磨標本」と言う。原理的に切削法ほど薄い標本は作れないほか、ダイヤモンド砥粒の消費や、機械を用いても仕上げは手作業(Handlap)になるので、コスト、時間が掛かるのが欠点。 |
| [染色]Staining | |
|---|---|
 染色工程  |
このように手間を掛けて作られた標本ですが、そのままでは殆ど色がありませんので通常の光学顕微鏡でそのまま観察してもその構造は理解できません。位相差顕微鏡や偏光顕微鏡、あるいは組織が自家蛍光を発する場合は蛍光顕微鏡などでそのまま観察できますが、通常の場合は組織を染色して観察できるようにします。 染色には後で述べるように目的によって多くの種類がありますが、その多くは水溶性の染色液を使うので、切片に残っているパラフィンをまず除去し(脱パラフィン)、最終的に水に馴染ませる(水和)操作が必要です。 さらに染色後は水分が残っているといずれ褪色しますので、再び充分に脱水をします。最後に封入剤を用いてカバーガラスで覆い固化させてやっと標本が完成します。 |
| <基本的な染色法> | |
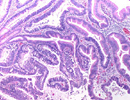 HE染色 組織像 |
染色には多くの種類がありますが、組織標本ではヘマトキシリン・エオジン染色(HE染色)が最も基本的な染色法として一般に広く行われています。これは、ヘマトキシリンの色素で細胞の核を紫色に、エオジンの色素で細胞質や結合組織などを赤色に染め分ける二重染色法です。(実はこのHE染色にも様々な種類があって、例えばヘマトキシリン染色液の処方にはマイヤー、ギル、ハリス、ワイゲルト、カラッチ等など幾つかありますし、エオジン染色液についても例えばフロキシンを加えたりとか、各施設によっていろいろな工夫がされており、個性豊かなものになっています。 いずれにしても作製された全ての組織標本はまずHE染色をされて、顕微鏡で形態的に観察され、その結果必要に応じて様々な特殊染色が追加されたり、組織化学反応、免疫組織化学反応を行うことになります。また、最初から特定の細胞や物質の検出を目的としてこれらを行う場合もあります。ただ、その場合には固定の段階からその目的に即した方法を検討しなければならないことも多くあります。 |
| < Special stain > | |
 SOF |
  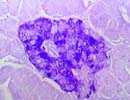 Grocott Oil-red O Aldehyde-Fuchsin |
| [鏡検]Observation | |
|---|---|
| <各種顕微鏡> | |
 鏡検 |
   |
| < Electro-microscpy > transmitted type (TEM) & scanning type (SEM) | |
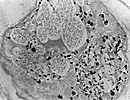 X 8k 100kV TEM |
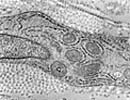   X 15k 100kV TEM X 5k 5kV SEM X 1.6k 5kV SEM |
| < Metal implant > | |
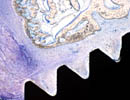 Ti |
   Ti Ti-6Al-4V Ti-6Al-4V |
| [顕微計測・画像解析]Analysis | |
|---|---|
 顕微計測・画像解析 |
|


