検体の取扱い
最終更新日:2013.08.06
当社では凍結組織や固定組織からの各種標本作製のほか、培養細胞などの細胞材料を対象とした試験研究業務も取扱っています。
また、自施設内に病理検査部門を有する医療機関、研究機関からの各種染色や遺伝子解析、画像解析などの御依頼にも応じており、各施設の状況に合わせてブロック、未染標本など幅広い材料・試料に対応しています。
そのほか、生体(動植物)からの組織・細胞以外にも食品、金属・樹脂など工学素材、鉱物など幅広い試料への技術応用を研究しています。
組織や細胞など生物試料は採取直後から経時的に変化・変性が始まります。採取直後の試料(検体)の処理は検査工程の一部と考えて迅速で適切な処理が必要です。以下、生物試料の取扱いについてご説明いたします。
固定組織での御依頼に際してのお願い
[ 1 ] 特殊な場合を除き固定液に浸漬したままの状態か、固定後70%エタノールなど低濃度アルコールに浸漬させてお送りください。
浸漬固定の場合は、試料の最大径より口径の広い容器に、試料容積の3倍量以上の固定液中に組織の全体が完全に浸るようにして固定してください。
※ 試料はなるべく早く固定液に浸して下さい。暖冷房の効いた室内で作業する場合などは組織表面が乾燥しやすくなります。
短時間放置せざるを得ない時は湿らせたガーゼを被せるなどして乾燥を避けて下さい。
※ 試料が固定液の液面より露出していると露出部が乾燥することがあり、染色性低下の原因になります。
※ 試料は固定すると弾力性を失います。口径の狭い容器では組織を取り出せなくなることがあります。
※ 皮膚や開いた腸管などは固定中に反ったり、歪んだりします。形を保持したい場合にはボード板などの上に組織を伸ばして広げ、端をピン止めしてから固定する方法があります。(伸展固定)
※ 軟らかい臓器などは変形して固定されることがあります。重力の影響を受けずに形を保持したい場合には糸などで縛って容器中に吊り下げて固定する方法があります。(懸垂固定)
[ 2 ] 項目や目的により最適な固定法が異なりますので使用した固定液の種類や時間などを御連絡下さい。また、一般に固定時間が長期にわたると染色性が低下する原因となりますのでご注意ください。
※ 動物組織はホルムアルデヒド系固定が、含水量の多い植物組織はアルコール系固定が汎用されますが、万能ではありません。
※ 脂質分析にはアルコール系固定は禁忌ですが、逆に糖質や低分子量の可溶性蛋白などはむしろアルコール系固定が適しています。
※ 脂肪の検出はホルマリン固定標本でも次の方法により実施可能です。
1)固定後、氷障防止処理をしてから凍結し、凍結切片を作製して脂肪染色を行う。
2)オスミウム酸で後固定を行い、パラフィン切片を作製する。(オスミウムは浸透力が弱いので大きな試料には適しません)
「脂肪染色は未固定凍結組織でしかできない」というのは誤解です。アルコールを使用するパラフィン包埋ができないというだけです。
※ TRAPなど一部を除き、多くの酵素は固定によって失活もしくは活性が低下します。またGFPなども固定すると発色しなくなります。
酵素活性やGFPの蛍光観察には未固定凍結組織が適しています。(蛋白として免疫学的に検出することは固定後の組織でも可能です)
[ 3 ] 固定液の種類によって組織内浸透速度が異なります。浸透力の弱い固定液を使用される場合は試料を小さく分割するか、適当な割を入れ試料内部に固定液が浸透しやすくすると固定は促進されます。 なお、単純に固定液の濃度を上げても浸透力は増しません。むしろ表面硬化により逆効果になることがあります。
※ 内容物を容れたままの腸管や嚢胞性組織、切除時に大量の血液が付着した場合などは除去しないと固定の妨げになります。
※ 肺のように含気量の多い臓器は浸漬するだけでは浸透しにくいので固定液の注入・抜気や還流固定の併用を御検討下さい。
※ 肝のように被膜で覆われた緻密な実質臓器は、そのまま固定液に浸漬するよりも半分に割る(半割)などした方が内部まで浸透しやすくなります。ただし、中途半端に割を入れると不規則な形で固定されることがあります。また、割面は膨潤しやすいので薄い臓器や湾曲した臓器などは注意が必要です。
[ 4 ] 固定液に浸漬したまま試料を移動・運搬する際には、安定な破損しにくい容器に入れて、液漏れしないように密封してください。液漏れは周囲を汚染するだけでなく、組織の乾燥の原因にもなります。万一、漏れても大丈夫なように、容器ごとビニールパックなどさらに包んで密閉しておくことをお勧めします。(二重に密閉するとなお安全です。)
[ 5 ] できるだけ再固定などの処理はしますが、固定不良の試料でのご依頼はお断りすることがありますのでご了承ください。
[ 6 ] 実質臓器などは原則として最大割面を標本にしますが、試料が大きい場合は標準的なガラス板に載る大きさにトリミングします。カット時の御指定があれば必ず事前に御連絡下さい。特に事前の御指定がない場合は、こちらに一任されたものと見做させて頂きますのでご了承ください。
[ 7 ] 組織の一部を切り出し・整形して、包埋用カセット容器に入れてお送り下さる場合は組織のどちら側の面が薄切希望面なのかが判るように指示して下さい。また、カセット容器への試料番号などの記載には、必ず鉛筆を使用して下さい。(耐薬液性のないマジックは絶対に使用しないでください)
(固定液については「各種固定液」の解説をご参照ください。自家調整が困難な場合は、当社から有償で供給可能な場合もありますのでご連絡ください。)
※ 試料はなるべく早く固定液に浸して下さい。暖冷房の効いた室内で作業する場合などは組織表面が乾燥しやすくなります。
短時間放置せざるを得ない時は湿らせたガーゼを被せるなどして乾燥を避けて下さい。
※ 試料が固定液の液面より露出していると露出部が乾燥することがあり、染色性低下の原因になります。
※ 試料は固定すると弾力性を失います。口径の狭い容器では組織を取り出せなくなることがあります。
※ 皮膚や開いた腸管などは固定中に反ったり、歪んだりします。形を保持したい場合にはボード板などの上に組織を伸ばして広げ、端をピン止めしてから固定する方法があります。(伸展固定)
※ 軟らかい臓器などは変形して固定されることがあります。重力の影響を受けずに形を保持したい場合には糸などで縛って容器中に吊り下げて固定する方法があります。(懸垂固定)
[ 2 ] 項目や目的により最適な固定法が異なりますので使用した固定液の種類や時間などを御連絡下さい。また、一般に固定時間が長期にわたると染色性が低下する原因となりますのでご注意ください。
※ 動物組織はホルムアルデヒド系固定が、含水量の多い植物組織はアルコール系固定が汎用されますが、万能ではありません。
※ 脂質分析にはアルコール系固定は禁忌ですが、逆に糖質や低分子量の可溶性蛋白などはむしろアルコール系固定が適しています。
※ 脂肪の検出はホルマリン固定標本でも次の方法により実施可能です。
1)固定後、氷障防止処理をしてから凍結し、凍結切片を作製して脂肪染色を行う。
2)オスミウム酸で後固定を行い、パラフィン切片を作製する。(オスミウムは浸透力が弱いので大きな試料には適しません)
「脂肪染色は未固定凍結組織でしかできない」というのは誤解です。アルコールを使用するパラフィン包埋ができないというだけです。
※ TRAPなど一部を除き、多くの酵素は固定によって失活もしくは活性が低下します。またGFPなども固定すると発色しなくなります。
酵素活性やGFPの蛍光観察には未固定凍結組織が適しています。(蛋白として免疫学的に検出することは固定後の組織でも可能です)
[ 3 ] 固定液の種類によって組織内浸透速度が異なります。浸透力の弱い固定液を使用される場合は試料を小さく分割するか、適当な割を入れ試料内部に固定液が浸透しやすくすると固定は促進されます。 なお、単純に固定液の濃度を上げても浸透力は増しません。むしろ表面硬化により逆効果になることがあります。
※ 内容物を容れたままの腸管や嚢胞性組織、切除時に大量の血液が付着した場合などは除去しないと固定の妨げになります。
※ 肺のように含気量の多い臓器は浸漬するだけでは浸透しにくいので固定液の注入・抜気や還流固定の併用を御検討下さい。
※ 肝のように被膜で覆われた緻密な実質臓器は、そのまま固定液に浸漬するよりも半分に割る(半割)などした方が内部まで浸透しやすくなります。ただし、中途半端に割を入れると不規則な形で固定されることがあります。また、割面は膨潤しやすいので薄い臓器や湾曲した臓器などは注意が必要です。
[ 4 ] 固定液に浸漬したまま試料を移動・運搬する際には、安定な破損しにくい容器に入れて、液漏れしないように密封してください。液漏れは周囲を汚染するだけでなく、組織の乾燥の原因にもなります。万一、漏れても大丈夫なように、容器ごとビニールパックなどさらに包んで密閉しておくことをお勧めします。(二重に密閉するとなお安全です。)
[ 5 ] できるだけ再固定などの処理はしますが、固定不良の試料でのご依頼はお断りすることがありますのでご了承ください。
[ 6 ] 実質臓器などは原則として最大割面を標本にしますが、試料が大きい場合は標準的なガラス板に載る大きさにトリミングします。カット時の御指定があれば必ず事前に御連絡下さい。特に事前の御指定がない場合は、こちらに一任されたものと見做させて頂きますのでご了承ください。
[ 7 ] 組織の一部を切り出し・整形して、包埋用カセット容器に入れてお送り下さる場合は組織のどちら側の面が薄切希望面なのかが判るように指示して下さい。また、カセット容器への試料番号などの記載には、必ず鉛筆を使用して下さい。(耐薬液性のないマジックは絶対に使用しないでください)
(固定液については「各種固定液」の解説をご参照ください。自家調整が困難な場合は、当社から有償で供給可能な場合もありますのでご連絡ください。)
凍結組織での御依頼に際して
[ 1 ] 摘出後すみやかに、液体窒素またはドライアイス・アセトン法等にて急速凍結を行い、凍らせたままお送り
ください。凍結前に組織を乾燥させたり、生理食塩水などに長時間浸漬しないでください。
[ 2 ] 氷点通過速度の遅い緩慢な凍結を行うと、氷結した水分によって組織構造が破壊されますので液体メディウムによって−80℃以下の低温下で急速凍結するようにしてください。冷凍庫中に放置して自然に凍結するのを待つようなことはしないでください。(分子間力の強いものほど熱伝導率は高いので、気体より液体の方が急速凍結の冷媒に適しています。)
一般的な病理形態学的目的の範囲では、一旦凍結した後の保管は溶けない程度の温度下でかまいません。むしろ液体窒素中などに長時間置くと組織は割れることがありますのでご注意ください。
[ 3 ] 凍結時には組織を直接単独で凍結する場合と、OCTコンパウド(クリオモルド)などの包埋剤に入れて固める場合とがあります。
組織直接凍結する場合:凍結後の組織を直接硬質プラスチックなどの容器に入れると移送中の衝撃により破砕しやすくなります。あらかじめ冷却したアルミホイールなどでゆるく包んでから容器に入れると緩衝効果があります。
包埋剤ごと固める場合:包埋皿(モルド=鋳型)に入れたまま輸送すると安全です。ただし、包埋剤は凍ると白濁・不透明になり組織の状態が見えなくなります。特に組織の包埋方向は後の工程に大きな制約を加えることになりますのでご注意ください。(凍結切片作製経験のある方向きです)
※ OCTコンパウンドなどの包埋剤はそのまま使用することを前提に作られています。添加物を加えたり希釈しないようにして下さい。
不純物の多い水は融点が下がるのと同じで、添加あるいは希釈すると均質で充分な凍結・硬化が起こらなくなることがあります。
[ 4 ] 凍結組織(残組織)や凍結ブロックは、場合によっては返却困難な場合があります。返却を希望される場合は事前に御相談下さい。また、凍結試料の一時預かりは1か月までとさせて頂き、万一その間に自然災害等予期せぬ事故が発生した場合の責任は当社としては負えませんので御了承ください。
(凍結用包埋剤やモルドは各種市販されています。入手困難な場合は、当社から有償で供給可能な場合もありますのでご相談ください。)
ください。凍結前に組織を乾燥させたり、生理食塩水などに長時間浸漬しないでください。
[ 2 ] 氷点通過速度の遅い緩慢な凍結を行うと、氷結した水分によって組織構造が破壊されますので液体メディウムによって−80℃以下の低温下で急速凍結するようにしてください。冷凍庫中に放置して自然に凍結するのを待つようなことはしないでください。(分子間力の強いものほど熱伝導率は高いので、気体より液体の方が急速凍結の冷媒に適しています。)
一般的な病理形態学的目的の範囲では、一旦凍結した後の保管は溶けない程度の温度下でかまいません。むしろ液体窒素中などに長時間置くと組織は割れることがありますのでご注意ください。
[ 3 ] 凍結時には組織を直接単独で凍結する場合と、OCTコンパウド(クリオモルド)などの包埋剤に入れて固める場合とがあります。
組織直接凍結する場合:凍結後の組織を直接硬質プラスチックなどの容器に入れると移送中の衝撃により破砕しやすくなります。あらかじめ冷却したアルミホイールなどでゆるく包んでから容器に入れると緩衝効果があります。
包埋剤ごと固める場合:包埋皿(モルド=鋳型)に入れたまま輸送すると安全です。ただし、包埋剤は凍ると白濁・不透明になり組織の状態が見えなくなります。特に組織の包埋方向は後の工程に大きな制約を加えることになりますのでご注意ください。(凍結切片作製経験のある方向きです)
※ OCTコンパウンドなどの包埋剤はそのまま使用することを前提に作られています。添加物を加えたり希釈しないようにして下さい。
不純物の多い水は融点が下がるのと同じで、添加あるいは希釈すると均質で充分な凍結・硬化が起こらなくなることがあります。
[ 4 ] 凍結組織(残組織)や凍結ブロックは、場合によっては返却困難な場合があります。返却を希望される場合は事前に御相談下さい。また、凍結試料の一時預かりは1か月までとさせて頂き、万一その間に自然災害等予期せぬ事故が発生した場合の責任は当社としては負えませんので御了承ください。
(凍結用包埋剤やモルドは各種市販されています。入手困難な場合は、当社から有償で供給可能な場合もありますのでご相談ください。)
培養細胞での御依頼に際して
[ 1 ] 原則として吸着細胞や細胞塗抹標本の作製が可能な場合は「細胞診」に準じてお取扱いください。試料や目的によっても異なりますが、一般的にはホルムアルデヒド系固定よりもアルコール系固定液の方が適している場合が多いと思います。
[ 2 ] スライドカルチャーの場合はチェンバー内に滴下式の細胞診用固定液(*)を注ぎ、10秒くらい後に余分な液を捨て、チェンバーをつけたままスライドをお送りください。 ポリエチレングリコールの被膜により保護され、室温で1週間くらいは保管できますが、埃が吸着したり、塗抹面を傷つけないようご注意ください。
[ 3 ] デイッシュの場合も基本的にはスライドと同様ですが、ディッシュの大きさ、厚さ、材質あるいは細胞層の厚さによってはディッシュごと処理できない場合がありますのでご相談ください。
[ 4 ] 浮遊細胞の場合は、細胞を洗浄した後、次のような処理が行われます。
1) 目的の細胞を分離し、細胞保存液(*)に入れて半固定状態のまま輸送する。
2) 遠心など集細胞処理を行い、薄層塗抹(Thin layer)標本を作製、細胞診に準じて固定し輸送する。
3) PFAなどの固定液を加え凝固・沈降させて輸送する。(ペレット法とかcell block法と呼ばれる方法です)
用途・目的によって最適な処理法が異なりますので事前にお問合せください。
[ 5 ] 3D培養の場合は形が崩れないようにしてお送り下さい。また、特殊な支持体を用いている場合は事前にお知らせ下さい。
(* 商品名は挙げませんが、いずれも各種市販されています。入手困難な場合は、当社から有償で供給可能な場合もありますのでご相談ください。)
[ 2 ] スライドカルチャーの場合はチェンバー内に滴下式の細胞診用固定液(*)を注ぎ、10秒くらい後に余分な液を捨て、チェンバーをつけたままスライドをお送りください。 ポリエチレングリコールの被膜により保護され、室温で1週間くらいは保管できますが、埃が吸着したり、塗抹面を傷つけないようご注意ください。
[ 3 ] デイッシュの場合も基本的にはスライドと同様ですが、ディッシュの大きさ、厚さ、材質あるいは細胞層の厚さによってはディッシュごと処理できない場合がありますのでご相談ください。
[ 4 ] 浮遊細胞の場合は、細胞を洗浄した後、次のような処理が行われます。
1) 目的の細胞を分離し、細胞保存液(*)に入れて半固定状態のまま輸送する。
2) 遠心など集細胞処理を行い、薄層塗抹(Thin layer)標本を作製、細胞診に準じて固定し輸送する。
3) PFAなどの固定液を加え凝固・沈降させて輸送する。(ペレット法とかcell block法と呼ばれる方法です)
用途・目的によって最適な処理法が異なりますので事前にお問合せください。
[ 5 ] 3D培養の場合は形が崩れないようにしてお送り下さい。また、特殊な支持体を用いている場合は事前にお知らせ下さい。
(* 商品名は挙げませんが、いずれも各種市販されています。入手困難な場合は、当社から有償で供給可能な場合もありますのでご相談ください。)
包埋済みブロックでの御依頼に際してのお願い
[ 1 ] パラフィン、エポキシ、メタクリレート樹脂等でのブロック作製は、必ず経験の豊富な専門技術者・技師の方にしていただくか、その指導を受けて行ってください。この工程は大変重要で、「切れないブロック」を作ってしまうと誰も切れません。ブロックの状態によっては依頼をお断りすることもありますのでご了承ください。
[ 2 ] ブロックを輸送される場合は、ブロックの表面(薄切面)が傷つかないようにご留意のうえ、高温・多湿の状態を避けて常温でお送りください。パラフィンブロックなどは冷却・冷凍すると収縮し亀裂が入ることがあります。その他の樹脂ブロックは、一般に吸湿性が高いので乾燥剤を同梱されることをお勧めします。(なお、セロイジンブロックは扱いが特殊ですので原則としてお引受していません)
[ 3 ] 包埋剤の変色や亀裂など変性・劣化が強い場合、不適切な保管により試料が乾燥・収縮・硬化したり陥没しているものでは薄切標本の作製は困難です。
[ 4 ] ブロックの状態によっては、予告なくこちらで再包埋をさせていただくこともあります。よくある問題点としては、①包埋方向、位置の不適切(薄切面の面出し不良を含む)、②薬液の浸透不良(抜気不良を含む)、③処理過程での組織の乾燥などですが、これらを元に戻してやり直すのは非常に大変な作業です。
問題のあるブロックとは? (パラフィン・ブロックの場合・・・実例です)
※ 中央部がへこんでいるもの、反っているもの、あるいは斜めになっていたり極端に薄いもの
※ パラフィンの端から組織が露出しているもの、あるいはパラフィン中に大きな空胞のあるもの
※ 組織が傾いて包埋されているもの、あるいは組織を深く埋め過ぎて上から見てもどこにあるのか解らないもの
※ パラフィンが均質ではなく、白濁の強い部分とそうでない部分、妙に半透明な部分がマーブル状に混在しているもの
※ パラフィンが断層状になっていたり、細かいクラックが生じているもの。
※ パラフィンが黄色く変色し、脆くなっているもの
※ 切ってみると組織の切り口が白濁しているもの(薬液の浸透不足です)
[ 2 ] ブロックを輸送される場合は、ブロックの表面(薄切面)が傷つかないようにご留意のうえ、高温・多湿の状態を避けて常温でお送りください。パラフィンブロックなどは冷却・冷凍すると収縮し亀裂が入ることがあります。その他の樹脂ブロックは、一般に吸湿性が高いので乾燥剤を同梱されることをお勧めします。(なお、セロイジンブロックは扱いが特殊ですので原則としてお引受していません)
[ 3 ] 包埋剤の変色や亀裂など変性・劣化が強い場合、不適切な保管により試料が乾燥・収縮・硬化したり陥没しているものでは薄切標本の作製は困難です。
[ 4 ] ブロックの状態によっては、予告なくこちらで再包埋をさせていただくこともあります。よくある問題点としては、①包埋方向、位置の不適切(薄切面の面出し不良を含む)、②薬液の浸透不良(抜気不良を含む)、③処理過程での組織の乾燥などですが、これらを元に戻してやり直すのは非常に大変な作業です。
問題のあるブロックとは? (パラフィン・ブロックの場合・・・実例です)
※ 中央部がへこんでいるもの、反っているもの、あるいは斜めになっていたり極端に薄いもの
※ パラフィンの端から組織が露出しているもの、あるいはパラフィン中に大きな空胞のあるもの
※ 組織が傾いて包埋されているもの、あるいは組織を深く埋め過ぎて上から見てもどこにあるのか解らないもの
※ パラフィンが均質ではなく、白濁の強い部分とそうでない部分、妙に半透明な部分がマーブル状に混在しているもの
※ パラフィンが断層状になっていたり、細かいクラックが生じているもの。
※ パラフィンが黄色く変色し、脆くなっているもの
※ 切ってみると組織の切り口が白濁しているもの(薬液の浸透不足です)
標本作製のみを御依頼される場合のお願い
作製した標本を何に使うのか、どのように使うのかなどを事前にお知らせ下さい。用途・目的によって処理法や作製法が異なってくることがあり、後からでは直しようの無い場合もあります。その他、御要望や指定事項は事前に具体的に説明をお願い致します。
なお、特に御要望・御指定のない場合は、通常のHE染色標本用の標本を作る感覚で対応させて頂きますので、御了承ください。
未染標本での御依頼に際してのお願い
(特に免疫組織化学の御依頼に際して)
[ 1 ] 切片はムラのない厚さ(4μ程度)にしてください。
薄過ぎる切片では反応は弱く、また酵素処理などで溶けてしまうことがあります。特に免疫組織化学では厚過ぎる切片や気泡や皺、傷の入った切片では非特異的反応が起こりやすく、熱処理などで切片が剥離しやすくなります。
[ 2 ] 原則的にスライドガラスはシラン(APS/MAS)コーティングスライドを使用してください。
免疫組織化学を行う場合は熱処理などで切片は剥がれやすくなりますのでAPSなどの接着剤をコーティングしたスライドガラスを御使用ください。 蛋白分解酵素処理を行うこともありますので、卵白アルブミンは接着剤としては不適です。
例外事項
・鍍銀など一部の特殊染色を行う場合は色素が非特異的に付着する原因となることがありますので接着剤は使用しないでください。一般に銀液を使用する染色には避けた方が賢明です。
・Laser microdissection(LMD)での回収を行う場合はコーティングスライドは不適です。(特に落下方式での回収時) また、RNase freeのスライドを使用すべき時もありますので事前に御確認下さい。
・蛍光抗体法で、特に無蛍光スライドなどを使用する必要のある時もあります。事前に御相談下さい。
[ 3 ] 切片は水をよく切ってガラスに貼付し、37℃で一晩乾燥させてください。
コーティングスライドを用いた場合、水分を残したまま伸展板上で加熱しますと切片とスライドガラスとが密着しないことがあります。スライドを立てるなどして切片とスライドとの間の水をよく切ってから37℃で充分乾燥させてください。染色の種類によっては60℃以上の温度で組織周囲のパラフィンを溶かすのは好ましくない場合があります。
乾燥後は切片の状態をよく確認してください。組織周囲のパラフィンが溶けているもの、切片の一部が白濁しているもの、切片の下に気泡が入っているもの、切片に傷、皺や折れ曲がりがあるものなどは接着剤を使用していても剥離しやすくなります。(接着剤等を過信するのは禁物です))
[ 4 ] 標本は薄切後なるべく1週間以内にお送りください。
きちんとカバーされ保管状態の良いブロックの場合、数年経ったブロックから新たに切片を作製しても多くの抗体は充分な反応を示しますが、一旦薄切した切片は経時的に反応が低下しやすくなり長期保存ができませんので薄切後はできるだけ早くお送りください。特に In situ Hybridization(ISH)の場合は御注意ください。
[ 5 ] 予備標本を必ず添付してください。
標本は1例ずつ条件が異なります。未知の検査材料に対して一回で満足な結果が得られるとは限りません。標準的な希釈倍率や反応条件が必ずしもその標本に最適でない場合もあります。これはまずやってみなければ判りませんので最初の1回は「予備試験」と考えてください。
また、脂肪織の多い材料や組織中へのパラフィンの浸透の良くないものは剥がれやすくなります。少しくらいの剥離は妥協して頂きますが、剥離がひどい場合は再染色することになります。
なお、できるだけ陽性対照標本を御用意のうえ試料に添付していただければ助かります。
(余った予備標本は原則としてお返ししませんので御了承ください。場合により精度管理用に使用させていただくこともあります。)
[ 6 ] 染色の目的、採取部位、固定法・時間などの情報を御記入ください。
目的や固定状況によっては反応条件を変える必要がある場合があります。(一例を挙げれば、クロモグラニンAは膵ラ氏島などに比べカルチノイドでは反応が弱く、さらに組織中に腫瘍細胞の占める割合が多い場合や固定時間が長い場合は一層弱くなりますので、その存在を証明するためには周囲組織が多少過染しても抗体濃度を上げる必要があります。)
また、採取部位によっては対象とする抗原の陽性対照となる成分を含む場合があり、わざわざ別に管理用陽性対照標本を用意する必要がありません。あらかじめ詳しい情報が判っていると前もって対処でき不必要なムダを省くことができます。(一部の抗体については陽性対照標本を確保するのが如何に大変なことかご理解ください。)
[ 7 ] 必要なことは必ず事前にお申出ください。
陽性対照、陰性対照あるいは吸収試験などが必要な場合は事前にお申出いただければ有償で対応致しますが、項目によっては対応が困難な場合もありますのでご了承ください。事前にお伺いしていない場合は不要なものとさせて頂きます。また、染色のprotocolや抗体のdata sheetなどの情報が必要な場合も事前にお願い致します。手順や試薬を変更することがあり、論文作成時にお問合せ頂いても変わっていることがあります。
その他、希望納期など要望事項、経理処理などご指定事項がある場合なども事前にお申出いただければできるだけ便宜を計るようにしますが、内容によっては対応できないこともありますのでご了承ください。。
[ 1 ] 切片はムラのない厚さ(4μ程度)にしてください。
薄過ぎる切片では反応は弱く、また酵素処理などで溶けてしまうことがあります。特に免疫組織化学では厚過ぎる切片や気泡や皺、傷の入った切片では非特異的反応が起こりやすく、熱処理などで切片が剥離しやすくなります。
[ 2 ] 原則的にスライドガラスはシラン(APS/MAS)コーティングスライドを使用してください。
免疫組織化学を行う場合は熱処理などで切片は剥がれやすくなりますのでAPSなどの接着剤をコーティングしたスライドガラスを御使用ください。 蛋白分解酵素処理を行うこともありますので、卵白アルブミンは接着剤としては不適です。
例外事項
・鍍銀など一部の特殊染色を行う場合は色素が非特異的に付着する原因となることがありますので接着剤は使用しないでください。一般に銀液を使用する染色には避けた方が賢明です。
・Laser microdissection(LMD)での回収を行う場合はコーティングスライドは不適です。(特に落下方式での回収時) また、RNase freeのスライドを使用すべき時もありますので事前に御確認下さい。
・蛍光抗体法で、特に無蛍光スライドなどを使用する必要のある時もあります。事前に御相談下さい。
[ 3 ] 切片は水をよく切ってガラスに貼付し、37℃で一晩乾燥させてください。
コーティングスライドを用いた場合、水分を残したまま伸展板上で加熱しますと切片とスライドガラスとが密着しないことがあります。スライドを立てるなどして切片とスライドとの間の水をよく切ってから37℃で充分乾燥させてください。染色の種類によっては60℃以上の温度で組織周囲のパラフィンを溶かすのは好ましくない場合があります。
乾燥後は切片の状態をよく確認してください。組織周囲のパラフィンが溶けているもの、切片の一部が白濁しているもの、切片の下に気泡が入っているもの、切片に傷、皺や折れ曲がりがあるものなどは接着剤を使用していても剥離しやすくなります。(接着剤等を過信するのは禁物です))
[ 4 ] 標本は薄切後なるべく1週間以内にお送りください。
きちんとカバーされ保管状態の良いブロックの場合、数年経ったブロックから新たに切片を作製しても多くの抗体は充分な反応を示しますが、一旦薄切した切片は経時的に反応が低下しやすくなり長期保存ができませんので薄切後はできるだけ早くお送りください。特に In situ Hybridization(ISH)の場合は御注意ください。
[ 5 ] 予備標本を必ず添付してください。
標本は1例ずつ条件が異なります。未知の検査材料に対して一回で満足な結果が得られるとは限りません。標準的な希釈倍率や反応条件が必ずしもその標本に最適でない場合もあります。これはまずやってみなければ判りませんので最初の1回は「予備試験」と考えてください。
また、脂肪織の多い材料や組織中へのパラフィンの浸透の良くないものは剥がれやすくなります。少しくらいの剥離は妥協して頂きますが、剥離がひどい場合は再染色することになります。
なお、できるだけ陽性対照標本を御用意のうえ試料に添付していただければ助かります。
(余った予備標本は原則としてお返ししませんので御了承ください。場合により精度管理用に使用させていただくこともあります。)
[ 6 ] 染色の目的、採取部位、固定法・時間などの情報を御記入ください。
目的や固定状況によっては反応条件を変える必要がある場合があります。(一例を挙げれば、クロモグラニンAは膵ラ氏島などに比べカルチノイドでは反応が弱く、さらに組織中に腫瘍細胞の占める割合が多い場合や固定時間が長い場合は一層弱くなりますので、その存在を証明するためには周囲組織が多少過染しても抗体濃度を上げる必要があります。)
また、採取部位によっては対象とする抗原の陽性対照となる成分を含む場合があり、わざわざ別に管理用陽性対照標本を用意する必要がありません。あらかじめ詳しい情報が判っていると前もって対処でき不必要なムダを省くことができます。(一部の抗体については陽性対照標本を確保するのが如何に大変なことかご理解ください。)
[ 7 ] 必要なことは必ず事前にお申出ください。
陽性対照、陰性対照あるいは吸収試験などが必要な場合は事前にお申出いただければ有償で対応致しますが、項目によっては対応が困難な場合もありますのでご了承ください。事前にお伺いしていない場合は不要なものとさせて頂きます。また、染色のprotocolや抗体のdata sheetなどの情報が必要な場合も事前にお願い致します。手順や試薬を変更することがあり、論文作成時にお問合せ頂いても変わっていることがあります。
その他、希望納期など要望事項、経理処理などご指定事項がある場合なども事前にお申出いただければできるだけ便宜を計るようにしますが、内容によっては対応できないこともありますのでご了承ください。。
 薄切後1w (RT) CD3 |
 薄切後2w (RT) CD3 |
 薄切後3w (RT) CD3 |
 薄切後4w (RT) CD3 |
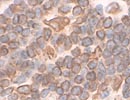 薄切後1w (RT) Vim |
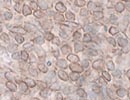 薄切後2w (RT) Vim |
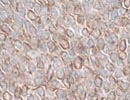 薄切後3w (RT) Vim |
 薄切後4w (RT) Vim |
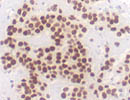 薄切後1w (RT) ER |
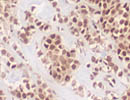 薄切後2w (RT) ER |
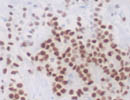 薄切後3w (RT) ER |
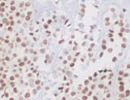 薄切後4w (RT) ER |
| 薄切後の切片を室温下で保存した場合の反応性の変化例を示す。表面抗原としてCD3、細胞質内抗原として細胞骨格のVimentin、核内抗原としてER(α)について、各々薄切した後の切片を室温で保存し、1週間ごとに同じprotocolで染色した。
抗原の性質、抗体の認識部位などにより一概には言えないが、薄切後2〜3週目くらいから反応の減弱がみられ、4週間後ではかなり反応は低下した。この傾向は、37℃、-40℃、-80℃などの温度や遮光/露光、通気/密閉など切片の保管条件を変えても大差なかった。
(この詳細は、道喜ほかにより第48回近畿医学検査学会にて報告した。) |
|||
対照標本の取扱いについて
[ 1 ] 免疫染色・特殊染色などでは、作業の精度管理上から下記のような陽性対照標本や、必要な場合には陰性対照標本を、試験対象標本と共に同時に染色することがあります。
[陽性対照]− Positive controlと呼ばれることもあります。
反応プロセスや試薬などの妥当性・適格性を評価するため、試験対象標本とは別に、検索目的とする蛋白・物質の存在が既知の標本を用います。
[陰性対照]− Negative controlと呼ばれることもあります
非特異的な反応を検証するため、試験対象標本に対して検索目的とする蛋白・物質と反応しない試薬(一般的には、一次抗体と同種動物の非免疫血清)を用います。
※ ここで言う「対照」とは、あくまでも染色プロセスにおける技術管理用の対照標本のことを指しています。染色プロセスのみを重視する臨床検査と違い、実験・研究においては、実験系全体に対する「陽性/陰性対照」(たとえば、「Sham」「対照群」など)という概念がありますので、混乱のないようにご注意ください。
[ 2 ] 免疫染色では、構造蛋白として常に発現している蛋白と異なり、特殊な状況下で発現が誘導されるような蛋白では既知陽性標本の確保が困難な場合があります。特に、ヒトの感染症で発現する物質の場合は臨床材料を使用せざるを得ません。技術管理のためということで御理解を頂いておりますが、それでも倫理的問題もあって常時大量に確保することはできません。従って、陽性対照標本を用意することができない場合があることもご理解ください。
[ 3 ] 私どもでは、毎日大量の対照標本を用いており、捨てるくらいなら参考標本としてご依頼された標本と共にお送りした方が良いという考えから無償で差し上げることがあります。ただ、あくまでも技術管理上の目的から、1工程1項目ごとに行っているわけですから、1項目で複数施設よりご依頼を受けた場合にはat randomに一部の施設にしか差し上げることができません。従って、陽性対照標本などの添付を毎回保証できるものではありません。 (対照標本であっても、試験対象標本と同じ経費が掛かります。逆に、たった1枚のために毎回損失を出している場合が実に多いこともご理解ください。)
[ 4 ] 対象項目の特異性に関わらず、対照標本の添付を「当然のサービス」のようにお考えの方もおられますが、私どもはそうは考えておりません。たとえ、私どもから無償で添付することがあったとしても、ご依頼者の側から「要求」される場合には有償での業務として扱わせていただきますので、ご了承ください。また、前述しましたように、私どもではすべての項目についての陽性対象標本を用意することができませんので、可能であればご依頼者の側で陽性対照標本(未染色標本)をご用意くださいますようお願い致します。
[陽性対照]− Positive controlと呼ばれることもあります。
反応プロセスや試薬などの妥当性・適格性を評価するため、試験対象標本とは別に、検索目的とする蛋白・物質の存在が既知の標本を用います。
[陰性対照]− Negative controlと呼ばれることもあります
非特異的な反応を検証するため、試験対象標本に対して検索目的とする蛋白・物質と反応しない試薬(一般的には、一次抗体と同種動物の非免疫血清)を用います。
※ ここで言う「対照」とは、あくまでも染色プロセスにおける技術管理用の対照標本のことを指しています。染色プロセスのみを重視する臨床検査と違い、実験・研究においては、実験系全体に対する「陽性/陰性対照」(たとえば、「Sham」「対照群」など)という概念がありますので、混乱のないようにご注意ください。
[ 2 ] 免疫染色では、構造蛋白として常に発現している蛋白と異なり、特殊な状況下で発現が誘導されるような蛋白では既知陽性標本の確保が困難な場合があります。特に、ヒトの感染症で発現する物質の場合は臨床材料を使用せざるを得ません。技術管理のためということで御理解を頂いておりますが、それでも倫理的問題もあって常時大量に確保することはできません。従って、陽性対照標本を用意することができない場合があることもご理解ください。
[ 3 ] 私どもでは、毎日大量の対照標本を用いており、捨てるくらいなら参考標本としてご依頼された標本と共にお送りした方が良いという考えから無償で差し上げることがあります。ただ、あくまでも技術管理上の目的から、1工程1項目ごとに行っているわけですから、1項目で複数施設よりご依頼を受けた場合にはat randomに一部の施設にしか差し上げることができません。従って、陽性対照標本などの添付を毎回保証できるものではありません。 (対照標本であっても、試験対象標本と同じ経費が掛かります。逆に、たった1枚のために毎回損失を出している場合が実に多いこともご理解ください。)
[ 4 ] 対象項目の特異性に関わらず、対照標本の添付を「当然のサービス」のようにお考えの方もおられますが、私どもはそうは考えておりません。たとえ、私どもから無償で添付することがあったとしても、ご依頼者の側から「要求」される場合には有償での業務として扱わせていただきますので、ご了承ください。また、前述しましたように、私どもではすべての項目についての陽性対象標本を用意することができませんので、可能であればご依頼者の側で陽性対照標本(未染色標本)をご用意くださいますようお願い致します。